
题目列表(包括答案和解析)
8.CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
A.Cs显+3价,I 、Cl 均显-1
B.Cs显 +1价,Cl显+1价,I显-1价、
C. 在CsICl2溶液中通入SO2气体,有硫酸生成
D.在CsICl2溶液中通入Cl2 ,有单质碘生成
7、下列盛放试剂的方法正确的是( )
A.氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中
B.汽油或煤油放存放在带橡皮塞的棕色玻璃瓶中
C.碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
6、将二氧化碳通入下列物质的溶液中不与其反应的是
①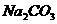 ②
②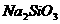 ③
③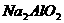 ④
④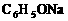
⑤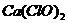 ⑥
⑥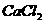 ⑦
⑦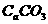
A.①③④⑤⑥ B.①⑥ C.① D.⑥
5.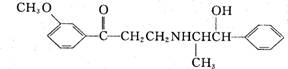 心酮胺是治疗冠心病的药物,它具有如下结构简式:
心酮胺是治疗冠心病的药物,它具有如下结构简式:
下列关于心酮胺的叙述错误的是
A.该物质是芳香族化合物 B.可以在催化剂作用下和溴反应
C.可以发生银镜反应 D.在一定条件下可以发生酯化反应
4、2004年10月13日有关媒体报道天津巨能化学有限公司生产的巨能钙含
有双氧水,经农业部产品质量监督检验测试中心检测,部分送检品种不同程
度地含双氧水。双氧水属于危险化学品及有毒有害物质,以前也曾作为漂白
剂、杀菌剂、防腐剂广泛用于食品中。下列有关H2O2的叙述中正确的是
A.H2O2是二元弱酸,将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失,一定是因为发生了酸碱中和反应
B.H2O2分子中含有非极性键,因此H2O2是非极性分子
C.H2O2的自然分解过程非常缓慢,一般不易察觉,但正因为如此,一般药用的双氧水在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可以使H2O2分解,因此人体即使吸收多量的H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
3.环丙烷的结构简式可表示为△,而环已烷因碳原子在空间排列方式不
同,有两种空间异构体(如图)a为船式,b为椅式的结构,当环已烷的不同
碳原子上连有两个重氢(D)原子时,包括重氢在六个碳环上位置不同与空间
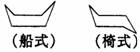 异构在内的异构体共有
异构在内的异构体共有
A.6种 B.12种
C.16种 D.10种
1.下列工业生产的说法错误的是
A. 氯碱工业中隔离两电极的材料是阳离子交换膜,因此该生产方法又称“阳离子交换膜法”
B. 生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉
C. 由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不采用高压的反应条件
D. 合成氨的反应是放热反应,因此工业合成常采用低温条件
2.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:3Zn -6e-+6OH- == 3Zn(OH)2
B.放电时正极反应为:2FeO42-+6e-+8H2O===2Fe(OH)3+10OH-
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
17.(本题共12分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
16.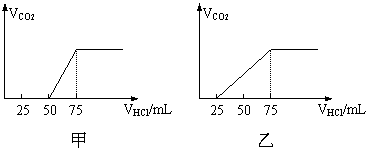 (12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
(12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,
其物质的量之比是 ,产生的CO2气体体积(标况)是 。
乙所得溶液中存在的溶质是 其物质的量之比是 ,产生的CO2气体体积(标况)是 。
15. (16分)(05全国卷I28.)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
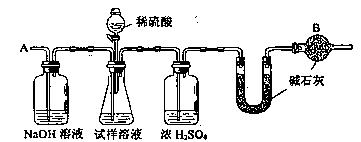
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴ 在用托盘天平称量关品时,如果天平的指针向左偏转,说明________________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________(填偏高、
偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com