
题目列表(包括答案和解析)
23.(9分)请完成下列有关氧化还原的问题:
(1)已知氧化性BrO3->ClO3->Cl2>IO3->I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
①可观察到的现象是:____________________________________________________;
②写出有关的离子方程式:________________________________________________。
 (2)一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e-=Cu2+;还原反应:Fe3++e-=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:氧化反应
还原反应
。
(2)一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e-=Cu2+;还原反应:Fe3++e-=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:氧化反应
还原反应
。
22.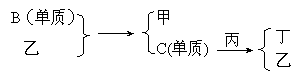 (9分)现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
(9分)现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
又知甲、乙、丙分子含有相同数目的质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是 (填写选项的编号,下同)(①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 。
A.化合物甲与丙、乙与丙均能够发生反应
B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为 。
(3)按(2)中的另外三个补充条件推断第四种元素。丙的空间构型为___________。
21.(9分)下表是元素周期表的一部分,表中所列字母分别代表化学元素。就表中所列字母所代表的元素,回答下列问题。
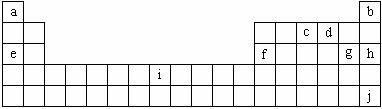
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图_____。
(2)由以上元素形成的金属单质中,熔点最低的是________(填写化学式),它在空气中燃烧时生成物的电子式为___________,将过量该氧化物投入到FeCl2的溶液中,氧化产物有(写化学式)___________________。
(3)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑。请预测首先被用来与F2反应制备稀有气体化合物的元素是______(填写字母)。利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式______________________________________。
20.(12分)下面是关于硫化氢的部分文献资料:
 资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度为0.1mol.L-1。硫化氢有剧毒,经黏膜吸收后危害中枢神经系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸能发生的反应主要有:
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度为0.1mol.L-1。硫化氢有剧毒,经黏膜吸收后危害中枢神经系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸能发生的反应主要有:
2H2S+O2=2H2O+2S 2H2S+3O2=2H2O+2SO2
2H2S+SO2=2H2O+3S H2S+Cl2=2HCl+3S
H2S=H2+S H2S+CuSO4=CuS↓+H2SO4
H2S+2NaOH=Na2S+2H2O H2S+NaOH=NaHS+H2O
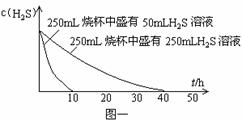 某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
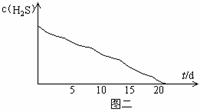 实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
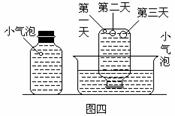
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象,如图三。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象,如图三。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊。当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊也更明显些,如图四。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为___________________。
两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了____的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会浑浊”的假设原因之一是(用文字说明)_______________________。此实验中通入空气的速度很慢的主要原因是什么?__________________________________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是______
_________________________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字简单说明实验设想,不需要回答实际步骤和设计实验方案)?________________。
19.(10分)试回答下列问题:
(1)量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积 10.0mL;100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积 100mL。(填:大于、等于或小于)
(2)欲量取20.00mLNa2CO3溶液,应选用的仪器是 。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________、_____________。
(4)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行______次。
18.在10mL2mol/L的稀硝酸溶液中,加入1.92g铜粉,充分反应后,再向其中加入1mol/L的硫酸溶液10mL,假设每步反应均充分进行,则最终溶液中c(Cu2+)为
A.1.50mol/L B.0.375mol/L C.0.50mol/L D.0.75mol/L
第Ⅱ卷(非选择题 共76分)
17.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是
A. B.
B.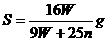
C.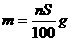 D.
D.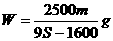
16.两只用惰性电极为两极的电解池,左池放CuSO4溶液,右池放一定量的某硝酸盐稀溶液。通电一段时间,当左池阴极上析出1.6g铜时,右池阴极上析出0.45g固体,则右池中的溶液可能为
A.Mg(NO3)2 B.Al(NO3)3 C.AgNO3 D.Cu(NO3)2
15.下列配制的溶液浓度偏高的是
A.配制盐酸溶液用量筒量取浓盐酸时俯视刻度线
B.配制盐酸溶液定容时,俯视容量瓶刻度线
C.称量4 gNaOH配制0.1mol.L-1NaOH溶液1000mL时,砝码错放左盘
D.配制前容量瓶中有少量蒸馏水
14.下列物质按沸点降低的顺序排列的是
A.CI4、CBr4、CCl4、CF4 B.石英、食盐、干冰、钾
C.HI、HBr、HC1、HF D.Li、Na、Mg、Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com