
题目列表(包括答案和解析)
26.(12分)向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量。
⑴方案一是否可行 填(“是”或“否”),理由是 。
⑵假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应;若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸。
⑶按物质的量之比为1:5配制1000mLKBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5molBr2。 取该溶液10mL加入足量乙醛溶液,使取褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 (选填猜想序号)。①取代反应;②加成反应;③氧化反应
⑷写出上述测定过程中的三个反应的离子方程式:
①KBrO3和KBr在酸性条件下的反应 :_________________________________ ;
②溴水与乙醛的反应:___________________________________________________ ;
③测定Br- 离子含量的反应:_____________________________________________ 。
25.(10分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
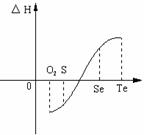
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)已知H2Te分解反应的△S>0,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示_________________,Ka值大小与温度的关系是:温度升高,Ka 值__________(填一定增大、一定减小、或可能增大也可能减小)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 ,此时α甲 α乙(填“大于”、“小于”或“等于”)。
24.(8分) 化学中用类比的方法可预测许多物质的性质。
如根据H2+Cl2 2HCl 推测:H2+Br2
2HCl 推测:H2+Br2 2HBr。但类同是相对的,如根据2Na2O2+2CO2
2HBr。但类同是相对的,如根据2Na2O2+2CO2 2Na2CO3+O2 类推:2Na2O2+2SO2
2Na2CO3+O2 类推:2Na2O2+2SO2 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2 Na2SO4。
Na2SO4。
⑴下列各组类比中正确的是 。
A.NH4Cl NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O CaCO3↓+2HClO
CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O CaSO3↓+2HClO
CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O Ca(HCO)2+2HClO
Ca(HCO)2+2HClO
推测:CO2+NaClO+H2O NaHCO3+HClO
NaHCO3+HClO
D.由Na2SO3+2HCl 2NaCl+H2O+SO2↑
2NaCl+H2O+SO2↑
推测:Na2SO3+2HNO3 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
⑵根据2Na + 2 H2O 2 NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
2 NaOH + H2↑的反应推断Na与液NH3反应的方程式为:
________________________________________________________________。
⑶由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式_________________________________________________________。
⑷从2F2+2H2O 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH 4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
23.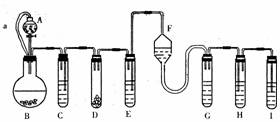 (10分)“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌一样。下面就是一个“化学多米诺实验”。
(10分)“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌一样。下面就是一个“化学多米诺实验”。
各装置中试剂或物质为:A--2mol·L-1H2SO4;B--Zn;C--2mol·L-1 H2SO4+CuSO4;
D--Zn E--CuSO4溶液;F--NH3·H2O;G--30%H2O2;H--H2S溶液;I--NaOH溶液。已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,该反应的产物可作H2O2分解的催化剂。
请回答下列问题:
(1)“化学多米诺实验”成功的关键之一是控制好第一个反应,之二是__________________。
(2)B与D两容器中反应速率比较B________D(填>、<、=),原因________________________
(3)H中的现象________________________________
(4)I的作用是(用离子方程式表示)________________________,
(5)A和B之间的导管a的作用是________________________。
(6)在该实验中涉及的反应类型是(填序号) ________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
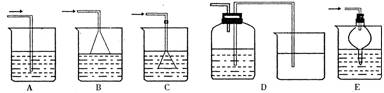
(7)如果从H中导出的气体是极易溶于水的气体,下列哪个装置能代替I? ________
22.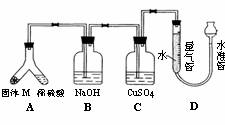 (14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
(14分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
由上述实验事实可知:
⑴①固体M中一定有的物质是_____________(填化学式)
理由是______________________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
⑵B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
⑶C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_____________________________________________________________。
⑷稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
⑸通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
21.(6分)⑴H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是二元酸(H2O2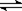 H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
H++HO2-),消耗了OH-,而使红色褪去。乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
(2)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简单的实验便知甲同学通的是Cl2还是SO2。他的实验方案是
。
20、在恒温时,一固定容积的容器内发生如下反应:2NO2(g) 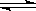 N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g) ,重新达到平衡后,与第一次平衡时相比,NO2 的体积分数:
N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g) ,重新达到平衡后,与第一次平衡时相比,NO2 的体积分数:
A.不变 B.增大 C.减小 D.无法判断
第Ⅱ卷 (非选择题,共80分)
19.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2- 。下列对该燃料电池说法正确的是:
A.在熔融电解质中,O2-由负极移向正极
B. 电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e- =2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2- =4CO2+5H2O
18.KO2的晶体结构和NaCl相似,可以看作是Na+的位置用K+代替,Cl- 的位置用O2-代替,下列对KO2晶体结构的描述正确的是:
A.和K+距离相同且最近的O2- 共有8个 B.和K+ 距离相同且最近的K+共有8个
C.和K+距离相同且最近的O2- 构成的多面体是正八面体
D.和K+距离相同且最近的O2- 构成的多面体是正六面体
0.01mol/L的烧碱溶液将酸中和,下列说法中正确的是:
A. 稀释前盐酸和醋酸的物质的量浓度相等 B.稀释后醋酸溶液的体积较大
C. 中和醋酸所用烧碱溶液的体积较大 D. 完全中和后两种溶液的pH值仍然相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com