
题目列表(包括答案和解析)
22.(10分)已知烯烃在不同条件下可与氯气发生加成反应或发生烷基氢的取代反应。现以原料A开始实现下列转化:
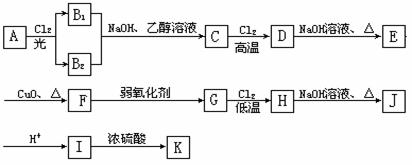
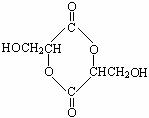 K的结构简式为:
K的结构简式为:
请回答下列问题:
⑴B1、B2的结构简式分别为: , 。
⑵E转化为F的化学方程式: 。
⑶H的结构简式为: 。
J的结构简式为 。
⑷写出上述属于加成反应的化学方程式 。
21.(12分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
[实验Ⅰ]学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
[实验Ⅱ]取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
[实验Ⅲ]换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是__________________________________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①___________________________________________________________________________;
②___________________________________________________________________________。
20.(9分)NH4NO3在不同条件(温度)下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应。
⑴若NH4NO3在通常条件下加热的分解产物不出下列范围,根据已学知识(化合价升降规律等)判断,下列反应可能的是 。
A、NH4NO3→N2+O2+H2O B、NH4NO3→NH3+HNO3
C、NH4NO3→O2+HNO3+H2O D、NH4NO3→N2+HNO3+H2O
E、NH4NO3→N2+NH3+H2O F、NH4NO3→N2O+H2O
⑵现将NH4NO3晶体在三种不同温度下加热使其分解,若分解产物能发生如图所示的转化关系(仅反应条件及反应Ⅱ、Ⅲ两个反应中生成的水被略去),回答下列问题:
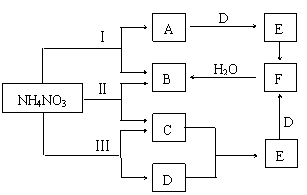

①写出下列物质的分子式
A、 E、 F、
②请写出反应Ⅲ的化学方程式 。
19.(8分)无机过氧化合物的科学研究开始于18世纪初,人们相继制得了过氧化钡、过氧化钠、过氧化钾、过氧化氢等,目前无机过氧化合物逐渐成为无机化学的一个分支,其中过氧化氢是用途最广的过氧化物。试回答下列问题。
⑴Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)。
⑵过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子方程式:
。
⑶与过氧化氢具有相同电子总数且属于非极性分子的有 、 (举两例,写化学式)。
⑷纯的过氧化氢常用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态过氧化氢反应,生成N2和H2O(g),放出256.6kJ的热量。.则该反应的热化学方程式为:
。
18.(11分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(注:NaOH溶液可吸收NOx)
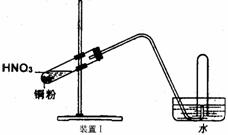
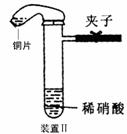
请回答下列问题:
⑴如何检验该装置Ⅰ的气密性?
。
⑵铜与稀硝酸反应的离子方程式为 。
⑶乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由 ,于是他设计装置Ⅱ。
⑷化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一: 。
措施:加热或 。
问题二:试管中的气体是淡棕红色,而不是无色。
措施:
(填具体操作。不能增加装置)。
问题三: 。
措施: 。
17.(8分)下列实验操作或对实验事实的叙述正确的是 (填序号)。
①为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③使用胶头滴管的任何实验都不允许将滴管插入液面以下
④为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑥用石英坩埚高温熔融NaOH和Na2CO3的固体混合物
⑦配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
⑧用洁净的玻璃棒蘸取浓HNO3,点在pH试纸中部以测定此浓HNO3的pH
16.甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
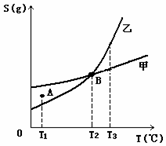 A.A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
A.A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B.B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液
的物质的量浓度相等
C.将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析
出的乙比析出的甲多
D.若乙中含有少量的甲,可用重结晶的方法提纯乙
第Ⅱ卷 (非选择题 共86分)
15.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)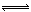 xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B)=n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)=12n(B)时,可断定x=4
14.强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1);ΔH=-57.3kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1);ΔH1
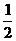 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=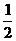 Na2SO4(aq)+H2O(1);ΔH2
Na2SO4(aq)+H2O(1);ΔH2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1);ΔH3
上述反应物除已注明的外均为稀溶液,则ΔH 1、ΔH 2、ΔH 3的关系正确的是
A.ΔH1=ΔH2=ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH2<ΔH 3<ΔH1 D.ΔH2=ΔH3<ΔH1
13.2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船(见下图)。有关C50Cl10的说法不正确的是
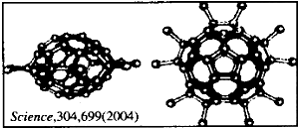
A.C50Cl10摩尔质量为955g·mol-1 B.C50Cl10晶体是原子晶体
C.C50Cl10分子中含有25个碳碳双键 D.C50Cl10分子中共用电子对数目为105
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com