
题目列表(包括答案和解析)
5.“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的"侯氏制碱法"的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
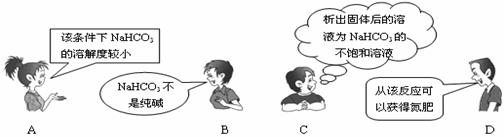
4.某溶液中含有:①HCO3-、②SO32-、③CO32-、④NO3-等四种阴离子,向其中加入足量Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
A.② B.②、③ C.①、④ D.④
3.下列有关物质用途的叙述中,不正确的是
A.硅可用作制造变压器的铁芯材料 B.石英玻璃可用于制造光学仪器
C.二氧化硅可用于制造光导纤维 D.水泥、玻璃、水晶饰物都是硅酸盐制品
D.水泥、玻璃、水晶饰物都是硅酸盐制品
2.下列矿物的主要成分中,既含铁元素,又含铜元素的是
A.赤铁矿 B.孔雀石 C.黄铜矿 D.石灰石
1.化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一
B.在食盐中加入适量的碘酸钾,是因为碘酸钾具有较强的氧化性,可抗人体老化
C.2009年,中国水电装机容量、核电在建规模、太阳能热水器集热面积和太阳能光伏发电累计容量均居世界第一位
D.竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.诺贝尔物理学奖曾授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型为 ,同层分子间的主要作用为 。
 (2)K3[Fe(CN)6]晶体中含有的化学键类型为 ,
(2)K3[Fe(CN)6]晶体中含有的化学键类型为 ,
Fe3+与CN-之间能够形成化学键的原因是 。
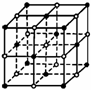
(3)等物质的量的氧化物MO与SiC的电子总数相等,则M2+
离子的核外电子排布式为 。
MO是优良的耐高温材料,其晶体结构与NaCl晶体相
似,晶体中与每个M2+等距离且最近的几个O2-所围成
的空间几何构型为 。
MO的熔点比CaO的高,原因是 。
B.某化工废液中可能含有下列微粒:Al3+、Fe3+、NO2-、甘油分子。化学兴趣小组的同学设计了下列实验验证这些微粒的存在。
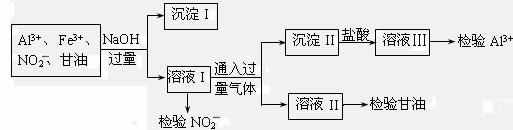
(1)分离出沉淀I的操作名称是 ,利用沉淀I可检验出 离子。
(2)通入的过量气体是 。(写化学式)
(3)用酸性KI溶液检验NO2-离子的离子方程式为 。
(4)写出检验甘油所发生反应的化学方程式: 。
(5)若向溶液III中先加足量NH4F后加氨水来检验Al3+离子,则能否达到目的?
答: (填“能”或“不能”);原因是 。
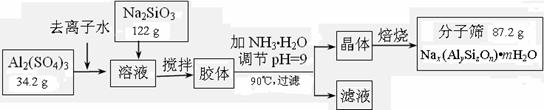
20.(10分)分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下:
|
(1)在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= 。
(2)生产流程中所得滤液的主要成分为 (写化学式)。
(3)假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%,试通过计算确定该分子筛的化学式(写出计算过程)。
(4)分子筛的孔道直径为4Å称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65Å)和异丁烷(分子直径为5.6Å)应该选用 型的分子筛。
19.(14分)苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示:
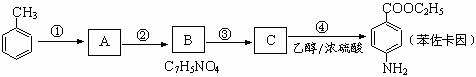
已知:① 当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
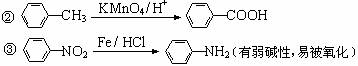
请回答下列问题:
(1)上述合成路线中属于取代反应的是 (填代号)。
化合物C中含有的含氧官能团的名称为 。
(2)合成路线中反应①的化学方程式为 。
(3)下列关于上述合成路线的说法中正确的是 。(填字母)
a.反应①除主要生成物质A外,还可能生成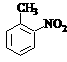 、
、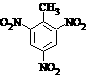 等
等
b.步骤①和②可以互换 c.反应③是还原反应
(4)苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: 。
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。
(5)化合物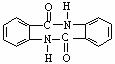 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
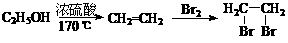
18.(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
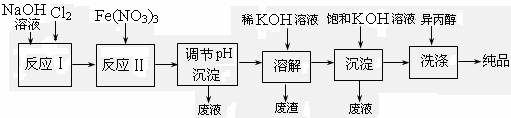
|
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水
 的原理为
,__________。
的原理为
,__________。
(3)干法制备K2FeO4的反应中,氧化剂与
还原剂的物质的量之比为 。
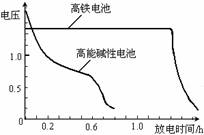
(4)高铁电池是正在研制中的可充电干电池,
右图为该电池和常用的高能碱性电池的
放电曲线,由此可得出的高铁电池的优
点有 、 。
17.(8分)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
。
 (2)联氨--空气燃料电池是一种碱性燃料电池,电
(2)联氨--空气燃料电池是一种碱性燃料电池,电
解质溶液是20%-30%的氢氧化钾溶液。该电
池放电时,正极的电极反应式为 。
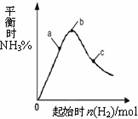
(3)在300℃时,改变起始反应物中氢气的物质的量
对反应N2(g) + 3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
的影响如右图所示。
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com