
题目列表(包括答案和解析)
1.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
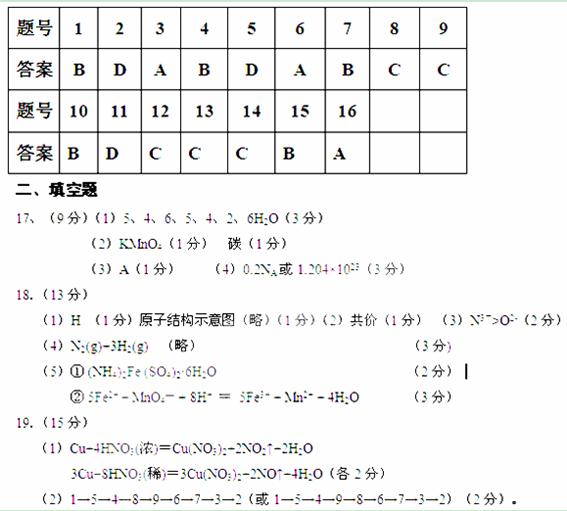 检查装置的气密性(1分)。
检查装置的气密性(1分)。
(3)排除整个装置系统中的空气(2分);
(4)D中气体变为红棕色(2分)。
(5)进行尾气处理,防治污染空气(2分) 把NO2和NO进行分离(2分)
20、(15分)
(1)取滤液少许,加入NaOH,加热,生成的气体能使湿润的红色石蕊试纸变蓝。(3分)(2)Al(OH)3+OH-=[Al(OH)4]- 3H2O+Al2O3+2OH-=2[Al(OH)4](各2分)
(3)(NH4)2SO4(1分)(4)BaCl2或Ba(NO3)2(1分)过滤、洗涤(2分) mol(4分)
20、(15分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
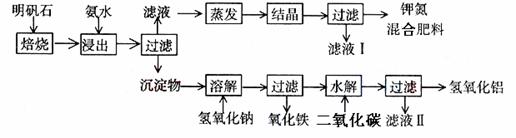
根据上述图示,完成下列填空:
⑴ 氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的
NH4+。检验NH4+的方法是________________________________________________。
⑵ 写出沉淀物加入氢氧化钠溶液发生反应的离子方程式:______________________ _____ __。
⑶ 滤液I的主要成分是水和______________。
⑷ 为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取mg钾氮混合肥料试样并溶于水,加入足量______溶液,产生白色沉淀。②___________、__________(依次填写实验操作名称)、灼烧、冷却、称重。③沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:______mol(用含有m、n的代数式表示)。
同安一中2010-2011学年上学期期中考高三理科
19.(15分)用下列仪器、药品验证由铜和适量浓硝酸反应所产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
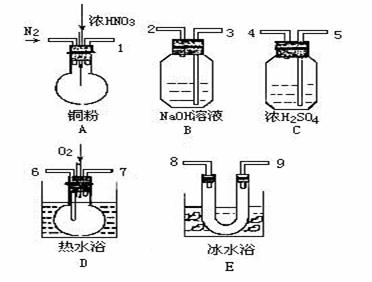
已知:① NO+NO2+2OH- =2NO2- +H2O
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)写出装置A中发生反应的化学方程式 。
(2)仪器的连接顺序(按左→右连接,填各接口的编号)为__ __。在添加药品前应先进行的操作是 。
(3)反应前先通入N2,目的是 ;
(4)确认气体中含NO的现象是________
(5)装置B的作用是 ,装置F的作用是 。
18.(13分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,W的单质为淡黄色固体,Y、Z左右相邻,Z、W位于同主族。
⑴ X元素是 ;W的原子结构示意图 。
⑵ X与W组成的化合物中存在 键(填“离子”“共价”)。
⑶ Y、Z形成的简单离子的半径由大到小的顺序为 。
⑷ 工业上由X的单质与Y的单质化合生成1molA时放出46.2kJ的热量,写出该反应的热化学方程式 。
⑸ 由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a. 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b. 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 。
② 已知1 mol·L-1 100mL B的溶液能与1 mol·L-1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
17.(9分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化法提纯,其反应式为:
(1)完成下列反应的化学方程式:(序数按顺序填在答题卷上)
___
C+ ___ KMnO4+ ____ H2SO4 ____CO2↑+ ____MnSO4
+ ____K2SO4+ ____□
(2)反应的氧化剂是 ,被氧化的元素名称是 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生1.12L(标准状况下)CO2气体,则转移的电子数是 。
16. 短周期的X、Y、Z三种主族元素,已知原子序数X+Z=2Y,若Z的最高价氧化物对应水化物是强酸,则下列有关说法中正确的是( )
A.若X是O,则YX一定是离子化合物
B.若X是Na,则Z的最高正价一定为偶数
C.若Y是O,则非金属性:Z>Y>X
D.若Y是Na,则X、Z不可能是同一主族元素
第Ⅱ卷 非选择题
15.“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
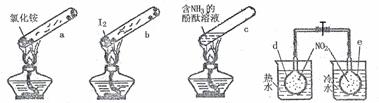
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色固体
C.加热时,c中溶液红色变深,冷却后又逐渐变浅
D.水浴时,d内气体颜色变浅,e内气体颜色变浅(2NO2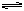 N2O4 ΔH<0)
N2O4 ΔH<0)
14.铝士矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。
 盐酸 过量NaOH
电解
盐酸 过量NaOH
电解
① ② ③ ④
下列说法错误的是( )
A.①、② 中除加试剂外。还需要进行过滤操作
B.a 、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d 一定是氧化铝
13.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物,每生成4 mol Fe(OH)3反应过程中共转移电子6 mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com