
题目列表(包括答案和解析)
18.碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4 g 的上述混合物,恰好消耗1.0 mol·L-1盐酸 500 mL。灼烧等量的上述混合物,得到的氧化铜质量是( )
A.15 g B.20 g C. 30 g D.40 g
第Ⅱ卷 非选择题(共46分)
17. 在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度.利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组( )
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
16.高铁酸钾(K2FeO4 )是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO― +4OH―=2FeO42-+3Cl― +5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.干法中每生成1mol Na2FeO4转移4 mol电子
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.高铁酸钾中铁显+3价
D.K2FeO4 处理水时,既能消毒杀菌,还能吸附水中的悬浮杂质
15. X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y
A.只有① B.只有②③ C.只有①④ D.①②③④
14.在常温常压下,已知:4Fe(s) + 3O2(g) = 2Fe2O3(s); ΔH1
4Al(s) + 3O2(g) = 2Al2O3(s); ΔH2
2Al(s) + Fe2O3(s) = Al2O3(s) + 2Fe(s); ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=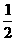 (ΔH1+ΔH2)
B.ΔH3=ΔH2-ΔH1
(ΔH1+ΔH2)
B.ΔH3=ΔH2-ΔH1
C.ΔH3=2(ΔH2+ΔH1)
D.ΔH3=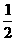 (ΔH2-ΔH1)
(ΔH2-ΔH1)
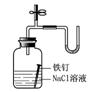
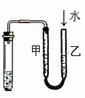
13.下列装置或操作能达到实验目的的是( )


|
A.①②③④ B.③④ C.②③④ D.①②
12.有下列三个反应:①Cl2 + FeI2 = FeCl2 + I2 ②2Fe2+ + Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O,下列说法正确的是( )
A.①②③中的氧化产物分别是FeCl2 、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2 > Co2O3 > Fe3+
C.在反应③中生成1mol Cl2时,有2molHCl被氧化
D.根据反应①②一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2
11.下列实验操作会导致实验结果偏低的是( )
①配制100 g 10%的CuSO4溶液,称取10 g 硫酸铜晶体溶于90 g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g,所得溶液的浓度
④用酸式滴定管量取用98%,密度为1.84 g/cm3的浓H2SO4配制200mL 2 mol·L-1的稀H2SO4时,先平视后仰视
A.只有① B.只有② C.②③④ D.①③④
10.有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl―、SO42―、HCO3―、MnO4― 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A.肯定有A13+、Mg2+、NH4+、Cl― B.肯定有A13+、Mg2+、HCO3―
C.肯定有K+、HCO3― 、MnO4― D.肯定有A13+、Mg2+、SO42―
9.向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2―形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2―形式存在于溶液中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com