
3、右图所示装置,有洗气、贮气等多种功能。下列关于该装置用途
的说法中正确的是
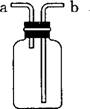 A、用排水法收集H2,瓶内装满水,气体从b管进
A、用排水法收集H2,瓶内装满水,气体从b管进
B、除去CO中的CO2,瓶内装NaOH溶液,气体从b管进
C、测量气体体积,瓶内装满水,气体从b管进a管接量筒
D、用于病人输氧,瓶内装水,a管接供氧钢瓶
2、通过下列变化,均无法得到单质的是
(1)分解反应 (2)化合反应 (3)置换反应 (4)复分解反应
A、(1)、(2) B、(1)、(2) C、(3)、(4) D、(2)、(4)
1、下列有关环境保护问题的叙述中,错误的是
A、“绿色化学”是指对环境无负面影响的化学
B、“白色化学”主要是指白色粉尘等对环境造成的污染
C、“温室效应”主要是指二氧化碳、甲烷等气体
D、“酸雨”是由大气中含硫和氮的氧化物等导致的
32、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。营养学家指出每天铝的安全摄入量为每千克体重0.7 mg。请回答下列问题:
(1)传统食品加工过程中,一般在1 kg面粉中加入l g明矾(已知:明矾的化学式为
KAl(SO4)2·12H2O,其相对分子质量是474;l g=1000 mg)。试求:
①l g明矾中含铝元素的质量(以mg为单位);
②该200 g食品中含铝元素的质量(以mg为单位);
③试通过计算,一个体重为50 kg的某同学,一天食用该食品150 g,他摄入的铝量 是否超过安全摄入量。
(2)为降低铝的摄入量,请你提出两条建议
① ②
(3)已知K2SO4溶液、KCl溶液的pH=7,AlCl3溶液、Al2(SO4)3溶液的pH<7。请猜想用明矾净化后的水,其PH______7。(填“>”、“<”或“=”)
31、一定质量的甲烷不完全燃烧时生成CO、CO2和H2O,已知产物的总质量为49.6g,其中有水25.2g。
求:(1)参加反应的甲烷为多少克? (2)生成CO、CO2各多少克?
(3)写出上述变化的化学方程式
30、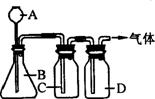 双氧水(H2O2)不仅可以在美容业除去色斑,也可以在常温
双氧水(H2O2)不仅可以在美容业除去色斑,也可以在常温
下以二氧化锰为催化剂制取氧气(2H2O2 2H2O+O2↑)。某
2H2O+O2↑)。某
同学设计了右图装置制取表中的三种干燥、纯净的气体。图
中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示
相应仪器中加入的试剂。
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法得到的气体,并说明理由(可以不填满,也可以补充).
①气体 ,理由是
②气体 ,理由是 。
|
气体 |
A |
B |
C |
D |
|
O2 |
双氧水溶液 |
二氧化锰 |
水 |
苛性钠固体 |
|
H2 |
稀硫酸 |
铜 |
氢氧化钠溶液 |
浓硫酸 |
|
CO2 |
稀盐酸 |
大理石 |
氢氧化钠溶液 |
浓硫酸 |
29、兴趣同学为制备纯净干燥的氢气,准备了下图所示的A、B、C三种装置。其中A装置最大的特点是可以随时使反应发生或停止。

(1)装置A中发生反应的化学方程式为 ;
(2)关闭弹簧夹时,A内的反应随即停止是因为
(3)装置B的作用是 装置C的作用是 ;
(4)为制备纯净干燥的氢气,A、B、C三种装置的连接顺序为 → →
(填字母序号)
28、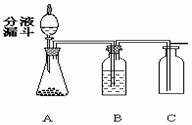 过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,
过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,
能迅速分解生成O2和H2O。分液漏斗可以通过调节活
塞控制液体的滴加速度。现欲制取干燥而纯净的氧气,
可采用下图装置:回答下列问题:
(1)分液漏斗中盛放的物质是 ;
(2) 装置B中的药品是 ;
(3)用该实验代替加热KMnO4制取O2,优点是 (填序号)
① 生成物只有氧气 ② 不需加热 ③ 生成氧气多
(4)如果要确认C中气体已经干燥,则需在B和C之间连接一个U型管,U型管中应放的物质为 。
(5)若改变装置A中的药品,此套装置还可以用来制取 气体。
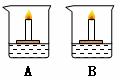 (6)两个同学在开展研究性学习时,做了一个十分有趣的实验,装置如下图所示。在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺。
(6)两个同学在开展研究性学习时,做了一个十分有趣的实验,装置如下图所示。在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺。
①烧杯A中蜡烛熄灭的原因是 _______________________________ ___,
撒入的无色晶体可能是 。
②烧杯B中蜡烛燃烧更旺的原因是 。
写出该反应的方程式 。
27、某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜。请根据他们的实验操作,回答下面有关问题:
(1) 向盛有一定量稀硫酸的烧杯中,放入一定量的铜粉。此时铜粉的表面是否有气泡冒出? (填“是”或“否”)
(2)加热烧杯中的稀硫酸和铜粉时,烧杯底部应垫上 ,使其受热 。
 (3) 如右图所示(图中加热装置未画出):将导气管口对着
(3) 如右图所示(图中加热装置未画出):将导气管口对着
铜粉连续不断地通入氧气。可以观察到铜粉逐渐减少,直至完
全消失。写出此过程中所发生反应的化学方程式:
; 。
 (4) 将所得到的溶液缓慢加热蒸发,至晶体析出。加
(4) 将所得到的溶液缓慢加热蒸发,至晶体析出。加
热时,除选用右图所示仪器外,还需补充仪器,所补
充的玻璃仪器是 ,
其作用是 。
26、钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注。某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究。
提出假设:a、Ti的金属活动性比Mg强; b、Ti的金属活动性介于Mg和Ag之间。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象。
请回答:(1) 三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 (填序号)
①除去氧化膜,利于直接反应
② 使反应的金属温度相同,易反应
③使表面光亮,易观察现象
(2) 根据下表中的实验现象填空:
|
|
Ti |
Mg |
Ag |
|
实验现象 |
产生气泡速度缓慢 |
产生气泡速度快 |
无任何现象 |
结论:原假设中 不正确(填“a”或“b”或“ab”),理由是
;三种金属的活动性由强到弱的顺序为 。
(3)上述实验设计中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确的结论? (填“是”或“否”),理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com