
2.下列家庭常用物质中,属于纯净物的是
(A)牛奶 (B)酱油
(C)蒸馏水 (D)葡萄酒,
1.世界是物质的,物质是变化的。下列日常生活中的变化属于化学变化的是
(A)钢铁生锈 (B)灯泡发光
(C)酒精挥发 (D)石蜡熔化
30.(9分)某钙片的标签如下图,且知此钙片成分中只有碳酸钙含有钙元素:
(1)请通过计算说明此标签中的含钙量是错误的。

(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:CaCO3+2HCI=CaCl2+H20+C02↑,充分反应后再称取烧杯和剩余物的总质量,小东做了三次实验,数据如下:
|
物质的质量 |
第1次 |
第2次 |
第3次 |
平均值 |
|
反应前:烧杯+盐酸 |
22g |
22g |
22g |
22g |
|
10片钙片 |
8g |
8g |
8g |
8g |
|
反应后:烧杯+剩余物 |
26.7g |
26.5g |
26.9g |
26.7g |
① 请列式计算每片此钙片含碳酸钙的质量。
② 请列式计算每片此钙片的含钙量,并建议厂家如何修改标签。
29.(7分)糖类(按C6H1206、计)在发酵时反应生成乙醇和二氧化碳,其化学反应方程式为:C6H1206=2C2H5OH+2C02↑,生活中1°的酒是指:1体积乙醇和99体积水的混合溶液,问:
(1)多少质量分数的糖类溶液发酵能得10的酒?(水和乙醇的密度分别为1.0g/cm3和O.8g/cm3)(结果保留一位小数)
(2)酿酒厂生产白酒时,常加入适量的一种稀酸溶液来控制酸度,发酵完成后进行蒸馏,即可得到白酒。根据所学化学知识,你认为应加入何种稀酸溶液来控制酸度?为什么?
28.(11分)维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性?
(2)实验方案:
提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、氢氧化钠溶液pH试纸。(实验仪器自选)
根据以上试剂,请你帮助他们设计出两种实验方案,并写出实验现象:
|
实验内容 |
实验现象 |
|
方案I: |
|
|
方案Ⅱ: |
|
(3)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是 ( )
A.金属镁 B.氯化钾 C.氢氧化钠 D.硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响?他设计了如下实验方案:
I 把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个杯中;
Ⅱ 取两支盛有2mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
|
汁液 |
新鲜西红柿的汁液 |
放置一周的西红柿的汁液 |
|
滴数 |
12 |
20 |
请回答下列问题:
①你认为西红柿中维生素C含量高的是_________________________________
②你从中得到的启示是______________________________________________
27.(4分)“绿色化学”强调实验设计应采取有效措施,节约能源、防止对环境的破坏和污染。
(1)下图A是小欣同学设计的一氧化碳还原氧化铁的实验。该实验符合“绿色化学”要求,体现在:为了防止污染,通过燃烧除去末反应完的,并充分利用其燃烧产生热量,节约能源;
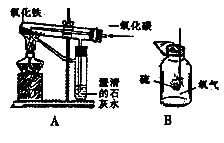
(2)写出上图B中发生反应的化学方程式_______________________________________,该实验不符合“绿色化学”要求,这是因为反应产物会逸散而污染空气,请你就此实验设计一个消除或减少污染的方法________________。
26.(4分)材料科学已成为当今世界上最热门的前沿学科之一。材料一般分为金属材料、无机非金属材料、合成材料和复合材料等。2005年3月28日,连续空缺6年的国家技术发明一等奖被授予中国工程院院士、中南大学校长黄伯云所领导的课组,因为他们发明了“高性能炭/炭航空制动材料的制备技术”。黄伯云是益阳南县人,他和他的创新团队历经20年、7000多个日日夜夜的拼搏,在经过无数失败之后,终于获得成功,不仅打破了欧美的垄断和技术封锁、而且性能更优。
(1)“炭/炭航空制动材料”中的两个“炭”字代表两种不同的含碳材料,由此制得的这种航空制动材料属于_______________材料。
(2)合成材料的大量使用有优点也有缺点,请你任意写出其中的优、缺点各一种:优点_______,缺点______________。
(3)从黄伯云的事迹中,对于科学探究,你有什么感想?
25.(6分)在锌和氧化铜混合粉末中,加入一定量的稀硫酸充分反应后过滤,发现滤纸上有锌和铜,则滤液所含的溶质是________________(填化学式)。该事实说明锌的金属活动性比铜_______(填“强”或“弱”)。请写出此过程中属于置换反应的化学方程式__________。
24.(8分)在研讨酸、碱、盐相互间反应关系时,甲、乙两组同学利用碳酸钠溶液按照以下步骤完成实验(假设每步反应都完全)。
第一步:向碳酸钠溶液中加试剂x,过滤,得白色沉淀;
第二步:向该沉淀中加试剂Y,沉淀全部溶解,生成气体,得无色溶液;
第三步:向该溶液中加试剂z,过滤,最终得不溶于酸的白色沉淀和硝酸镁溶液。
(1)甲、乙两组同学共进行三次实验,其中所选的试剂均不相同,乙组同学最终得到的不溶于酸的白色沉淀不同于甲组。请将化学式填入下表:
|
|
试剂X |
试剂Y |
试剂Z |
最终得到的白色沉淀 |
|
|
甲组 |
① |
MgCl2 |
|
|
AgCl |
|
乙组 |
② |
|
HNO3 |
|
|
|
③ |
|
|
|
(2)请写出乙组两次实验中碳酸钠溶液与试剂x反应的化学方程式:
____________________、________________________________________。
23.(5分)我国自主研发设计的海水法脱硫工艺,已成功应用于大、中型火电机组。其工艺大致流程是:从高而下的海水洗脱从下而上燃煤烟气中的S02,然后与氧气充分接触,再采取跟大量天然海水(pH为8.1-8.3)混合等措施,使各项指标接近天然海水后再排放。
某海滨发电厂(6x600MW)的海水脱硫法与其它脱硫法对比项目如下表所示:
|
对比项目 |
海水法 |
氧化镁法 |
石灰石法 |
|
脱硫效率 |
>90% |
80% |
>90% |
|
矿石消耗量 |
无 |
3万吨/年(氧化镁) |
17.5万吨/年(石灰石) |
|
淡水消耗量 |
无 |
150万吨/年 |
数百万吨/年 |
|
脱硫电价成本 |
¥0.6分/度电 |
¥1.3分/度电 |
>¥1.5分/度电 |
(1)根据上述内容,归纳海水法脱硫的优势和局限。
优势是_____、_____;局限是:________________________________________。
(2)已知洗过烟气后的海水与氧气反应的产物是硫酸钠和盐酸:试写出该反应的化学方程式:___________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com