
1.下列生产生活中发生的变化属于化学变化的是 ( )
21.(10分)碳酸钠,化学式Na2CO3,俗称纯碱。“纯碱中常常会混有少量的氯化钠”。某研究性学习小组以一包纯碱(若有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的含量。请你参与他们的活动。
[小组讨论]
观点Ⅰ:纯碱样品中只含有碳酸钠
观点Ⅱ:纯碱样品是由碳酸钠和少量氯化钠组成的混合物
[实验设计]
甲方案
Ⅰ 设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
Ⅱ 操作步骤:称取13.25g纯碱样品,加入过量的澄清石灰水,充分搅拌。过滤、洗涤、干燥,得到白色沉淀10.00g
Ⅲ 数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数。
计算过程:
Ⅳ 实验结论:__________________________________________________________________。
乙方案
Ⅰ 设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
Ⅱ 实验结论:
(1)当a、b的质量关系满足___________________(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100﹪。
(2)当a、b的质量关系满足__________________时,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是______________________________________。
[实验评价]
误差分析:(1)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小。(2)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比______________(填写“偏大”、 “偏小”或“不变”)。
[交流反思]
(1)实验过程中,需用玻璃棒不断搅拌,该操作的目的是_________________________ 。
(2)甲方案实验操作中,对沉淀洗涤的目的是:_________________________________。
(3)乙方案中,需用一定质量的19.6﹪的稀硫酸。现有一瓶98﹪的浓硫酸(密度为1.84g/cm3),配制乙方案中实验所用稀硫酸,至少需要浓硫酸的体积是___________mL(填写含字母的表达式)。浓硫酸稀释的正确操作是_______________________________。
20.(5分)实验室有A、B、C、D四瓶无色溶液,分别是稀硫酸(H2SO4)、饱和石灰水
[Ca(OH)2]、氢氧化钠溶液(NaOH)、碳酸钠(Na2CO3)溶液四种物质中的一种。可供使用的实验用品有:pH试纸、稀盐酸、玻璃棒、试管、玻璃管。
(1)请利用提供的实验用品,鉴别出四种物质,并完成实验报告:
|
实验步骤 |
实验现象 |
实验结论 |
|
①取样,分别用玻璃棒蘸取四种溶液,滴到pH试纸上,与标准比色卡对照 |
B的溶液的pH<7,其余溶液的pH>7 |
B是________溶液 |
|
②取三支试管,各取少量的A、C、D溶液,分别滴加稀盐酸 |
_________________ |
A是碳酸钠溶液 |
|
③取两支试管,各取少量的C、D溶液,用玻璃管分别吹入CO2 |
_________________ |
C是饱和石灰水 |
(2)小明认为:不用任何试剂,只要几支试管即可完成鉴别实验。他将四瓶试剂重新编号,并将四种溶液两两混合,部分实验结果记录如下。
|
两两混合 |
A+B |
B+C |
C+D |
A+D |
|
实验现象 |
↓ |
↑ |
/ |
/ |
则小明可以得到的结果为:A是___________________,D是______________________。
19.(5分)根据下列仪器,回答有关问题:
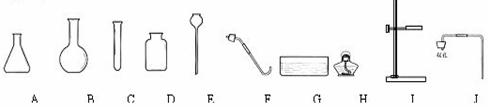
(1)上图A、B、C、D中能直接加热的仪器是填写仪器名称。
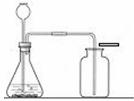
(2)下图为小明组装的CO2制取装置,装药品前首先进行的操作是___________________
_________________。他认为该装置也可用于制取氧气,其制取氧气的化学方程式为_____
_______________________________________。
(3)小明拟选用仪器C、D、F、G、H再设计一套制取氧气的装置,他还需选用的仪器是_________(填写仪器序号),该装置中所用的药品是____________________________(填写药品名称)。
18.(9分)我市有江苏最长的海岸线、最大的沿海滩涂、最大的海域面积……“沿海兴,则盐城兴”。某校学生以此为主题展开相关研究。
(1)盐城在古代以盛产“盐”而得名。通过晾晒海水或煮盐井水等,可以得到粗盐。
①海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可通过下列步骤制取精盐:
溶解→过滤→__________________(填写操作步骤)。如果两次过滤后滤液仍浑浊,原因可能是________________________________________________________(写出一种即可)。
②粗盐提纯实验中,先称取5.0g粗盐,量取10mL水只溶解4.0g粗盐,最终得到3.6g精盐,则精盐的产率是___________。
(2)我市有蕴藏量丰富的石油天然气,有丰富的沿海风力资源。风电场的建成投产,有助于减少CO2的排放。
①天然气是不可再生能源,其主要成分为______________________。
②CO2的排放是造成“温室效应”的原因之一。下列说法正确的有___________________
(填写选项序号)。
A.植树造林,严禁乱砍滥伐树木
B.节约能源,减少煤、石油等化石燃料的燃烧
C.严禁钢材、铝材、铁合金、氧化铝等高能耗产业的生产
D.开发新技术,利用太阳能、核能、风能、地热能等新能源
(3)在沿海经济大开发的进程中,要坚持开发与环保并重。
①某化工厂有甲、乙两个车间,排出的废水澄清透明,分别含有三种不同的离子,共有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子(部分物质的溶解性见下表)。已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离子是_________________。将甲、乙两车间的废水按适当比例混合,可以变废为宝,既能使废水中的Ba2+、Cu2+、OH-等离子转化为沉淀除去,又可以用上层清夜浇灌农田。清夜中的溶质主要是___________________(填写物质化学式)。
|
阴离子 阳离子 |
OH- |
NO3- |
CO32- |
|
K+ |
|
|
|
|
Ba2+ |
|
|
|
|
Cu2+ |
|
|
|
②根据上表判断,Cu(NO3)2和Ba(OH)2溶液_______(填写“能”或“不能”)发生复分解反应。能反应的写出化学方程式,不能反应的写出理由:__________________________。
17.(5分)小明把同学对生活中的某些现象或问题的讨论用表格的形式归纳如下。请按要求填写下表(“A”或“B”)。
|
生活中的现象或问题 |
分析或方法一 |
分析或方法二 |
正确选项 |
|
(1)饭菜飘香 |
A.分子在不停地运动 |
B.分子间有间隔 |
|
|
(2)某中学生常用食谱:红烧肉、 清炖鳊鱼、麻辣豆腐、米饭 |
A.缺少蛋白质 |
B.缺少维生素 |
|
|
(3)打开汽水瓶盖,冒出大量气泡 |
A.气体的溶解度随压强的减小而减小 |
B.气体的溶解度随温度的升高而减小 |
|
|
(4)油腻的菜盘用加入洗涤剂的水更易洗净 |
A.洗涤剂能使油脂溶解在水中 |
B.洗涤剂具有乳化的功能 |
|
|
(5)判断衣料中是否含有羊毛成分 |
A.看光泽度,用手摸 |
B.燃烧,闻气味 |
|
16.(6分)(1)用下列物质填空(填写字母) :a .干冰、b.活性炭、c.碳酸氢钠、d.尿素。
①可用于除去水中异味的物质是____________;②可用于人工降雨的物质是____________;
③可用于焙制糕点的物质的是______________;④可用作氮肥的物质是________________。
(2)氧气(O2)是人类赖以生存的重要物质之一。下图摘自元素周期表,据图你从中获得的信息有(写出两点即可):

①__________________________________________________;
②__________________________________________________。
15.下图为熟石灰的溶解度曲线。向20℃的饱和澄清石灰水(甲溶液)中加入少量氧化钙(CaO)粉末,充分反应。下列对反应后溶液的说法中,错误的是
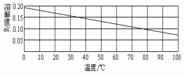
A.溶液温度未恢复到20℃时,溶液一定是饱和溶液
B.溶液温度未恢复到20℃时,溶质质量分数比甲溶液的大
C.溶液温度恢复到20℃时,溶质质量比甲溶液的质量小
D.溶液温度恢复到20℃时,溶质质量分数与甲溶液的相等
试卷Ⅱ(非选择题,共40分)
14.对X、Y、Z三种金属活动性的实验研究过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,X、Z表面出现红色物质,Y没有现象。(2)取大小相等的X、Z两种金属片,分别放入相同的稀盐酸中,XZ表面都产生气泡,但X产生气泡的速度明显比Z的快。则X、Y、Z三种金属的活动性顺序是
A.X>Z>Y B.Z>Y>X
C.X>Y>Z D.Z>X>Y
13.下列说法错误的是
A.氧化反应不一定要有氧气参加
B.化学反应的发生伴随着能量的变化
C.不锈钢比纯铁硬,抗腐蚀性比纯铁好
D.取A、B两种物质各10g混合,充分反应后生成物的总质量一定为20g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com