
4.今年,我省部分地区已经开始使用天然气,天然气的主要成分是甲烷,其化学式为CH4,下列四位同学在讨论化学式CH4的意义,其中错误的是
A.表示甲烷这种物质
B.表示一个甲烷分子
C.表示甲烷由碳氢两种元素组成
D.表示甲烷气体由一个碳原子和四个氢原子组成
3.同种元素的原子一定具有相同的
A.质子 B.中子数 C.电子数 D.相对原子质量
2.以下常见物质中属于纯净物的是
A.洁净的空气 B.酸奶 C.二氧化碳 D.自来水
1.下列叙述中,属于化学变化的是
A.湿衣服晾干 B.粮食酿成酒 C.瓷碗摔碎 D.液态水气化
32.将氯酸钾与二氧化锰的混合粉末28.5g加热到不再放出氧气为止,得到固体残留物18.9g,化学反应方程式为:2KClO3
 2KCl + 3O2↑ 。试计算:(1)生成氧气多少克?(2)残留固体中都含有什么?各多少克?
2KCl + 3O2↑ 。试计算:(1)生成氧气多少克?(2)残留固体中都含有什么?各多少克?
31.某菜农原计划每亩菜田施用硝酸铵(化学式为NH4NO3)16kg,因硝酸铵缺货,现改施用尿素[化学式为CO(NH2)2],若要达到同样的含氮质量,则每亩菜田所需尿素多少千克?
30.、为了避免实验失败甚至造成严重后果,有些化学实验必须严格遵循操作的顺序,例如,点燃氢气前必须先验纯,再点燃。请你仿照示例填写下表1、2中的空格,再举出1个必须严格遵循操作顺序的实验,填写下表3中的所有空格:
|
必须严格遵循操作顺序的实验 |
先做什么 |
再做什么 |
|
示例:点燃氢气 |
先验纯 |
再点燃 |
|
1、铁丝在氧气中燃烧 |
先 |
再把系有燃着的火柴棒的铁丝伸入集气瓶中 |
|
2、制取O2气体 |
先检查装置的气密性 |
再 |
|
3、 |
|
|
29.“用双氧水和二氧化锰制氧气”的反应方程式为: 。
实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
|
实 验 次 序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
MnO2粉末用量(克) |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
|
所用时间(秒) |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
请分析表中数据并回答有关MnO2的用量对反应速率的影响情况:当催化剂MnO2的用量增加时,反应速率___________(填“加快”、“减慢”或“不变”),当催化剂MnO2的用量增加到一定程度时,反应速率 。
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
|
实 验 次 序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
H2O2溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
20% |
25% |
30% |
|
MnO2粉末用量(克) |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
收集到540mL气体时所用时间(秒) |
660 |
220 |
205 |
80 |
25 |
9 |
4 |
3 |
|
反应后液体温度(℃) |
24 |
34 |
39 |
56 |
65 |
67 |
69 |
70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率的影响情况是: ,表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。
(3)由此可看出,催化剂的用量、过氧化氢溶液的浓度(即溶质质量分数)等都是影响过氧化氢分解的反应速率的因素。实际上,影响化学反应速率的因素还有很多。请你仿照示例,结合实际生活中的例子,再举一例。示例:温度越高,反应越快。如在高温时,铜在空气中容易被氧化。
28.马强和几位同学在实验室用下列装置制取几种气体。
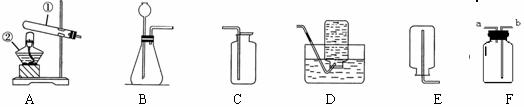
(1)写出图中标有①、②的仪器名称:① ② 。
(2)陈超用过氧化氢和二氧化锰混合制取氧气,其中二氧化锰起 作用。可以选用 和 或 (填字母)进行组装。你认为长颈漏斗的末端插入液面以下的目的是 。
(3)张民同学用高锰酸钾制取和收集氧气,他选择的装置组合是 、 _(填装置的字母代号)。装置A还缺少的一种用品是_____________;如用F装置收集氧气应从 管进气(填a或b)。
(4)实验结束后,陈超问:“我用带火星的木条伸入集气瓶内,为什么不会复燃?”请你帮助陈超推测导致这种现象的原因 。(写一个)
(5)用过氧化氢和二氧化锰混合制取氧气的优点是 、 。
27.一氧化氮是大气的主要污染物之一。近几年来,又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。
⑴一氧化氮是工业制硝酸的中间产物,生成一氧化氮反应的化学方程式为:
4X+5O2 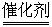 4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
⑵汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理的方法是在汽车尾气的排风管上装一个催化转换器,在催化剂的作用下,一氧化氮与一氧化碳反应可生成二氧化碳和氮气,该反应的化学方程式为: 。
⑶某同学希望了解尾气中一氧化碳的含量,于是在环保科研人员的帮助下,采集了一定量的汽车尾气,并把它转化为二氧化碳和氮气。下面该同学该怎样将二氧化碳和氮气分开呢?并设法计算出一氧化碳的含量 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com