
4.20世纪20年代,曾有人预言可能存在由4个氧原子组成的氧分子(O4),但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出这种新型氧分子,并用质谱仪探测到了它的存在。下列叙述中正确的是 ( )
A.O4是一种新型的化合物
B.一个O4分子中含有2个O2分子
C.O4和O2的性质完全相同
D.O4和O2混合后形成的是混合物
3.实验室里不同化学试剂的保存方法不尽相同。①NaOH溶液;②大理石;③NaCl溶液;④稀硝酸四种试剂通常各自存放在图14-1所示的某种试剂瓶中。按照试剂瓶的顺序存放试剂的序号正确的是( )
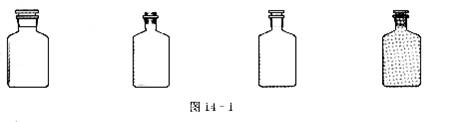
A.①②③④ B.②①④③ C.②③④① D.②①③④
2.月球的土壤中吸附着数百万吨的氦(He-3),其原子核中质子数为2、中子数为1,下列关于氦(He-3)元素的说法正确的是 ( )
A.原子核外电子数为3 B.相对原子质量为2
C.原子的核电荷数为3 D.原子结构示意图为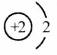
1.食品安全与人体健康密切相关。下列做法中对人体健康有危害的是( )
A.蒸馒头时加入适量的纯碱
B.在装小食品的袋子中充入氮气
C.用石灰水保存鲜蛋
D.制香肠时加入过量的亚硝酸钠
31.现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图l3-15所示。请根据有关信息计算:
(1)该试剂瓶中硫酸溶液的质量是 g。工人小李用该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈。他在配制该溶液时所用98%的浓硫酸与水的质量比应该为 。
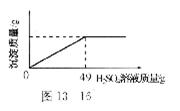
(2)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图13-16所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量。
(3)若加入的稀硫酸刚好使沉淀达最大量时,将

所得混合物过滤、洗涤,得滤液2009(过程中损耗忽略不计),计算该滤液中溶质的质量分数。(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)
30.课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其他杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
[粗产品制备]
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为 。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
[粗产品成分分析]
(1)取适量粗产品溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ,该粗产品中一定不含有 ,理由是
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
[粗产品含量测定]
Na2CO3含量的测定:
(1)该兴趣小组的同学设计了图l3-14所示的实验装置。取10.0g粗产品,进行实验。
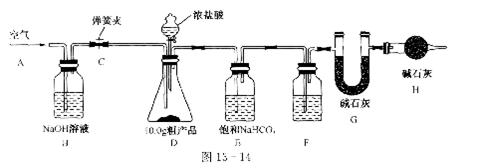
[说明]碱石灰是CaO与NaOH的固体混合物。E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为
NaHCO3+HCl==NaCl+ H2O +CO2
(2)操作步骤
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通人一段时间空气;⑥再次称量G的质量,得前后两次质量差为0.48g。
(3)问题探究
F中的试剂应为 ,B装置的作用是 ,H装置的作用是 。若没有H装置,则测定的Na2CO3的质量分数会 (填“偏大”、“偏小”或“不变”)。事实上10.0g粗产品只能产生0.449g CO2。请你仔细分析上述实验,解释实验值0.48g比正确值0.44g偏大的原因(假设操作均正确):
(4)数据计算
根据正确值0.44g可求得粗产品中Na2CO3的质量分数为 %。NaOH含量的测定:
该小组同学又另取10.0g粗产品,逐滴加人20%的盐酸至恰好完全反应时,消耗盐酸的质量为36.5g.放出CO20.44g(不考虑二氧化碳气体的溶解)。求原粗产品中NaOH的质量分数。(写出计算过程)
29.小兵同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损。诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶液中的一种。小兵同学通过查阅资料得知,常温下这三种物质的溶解度见下表:

|
物质 |
H2SO4 |
Na2SO4 |
Mg SO4 |
|
溶解度/g |
与水任意比互溶 |
19.0 |
39.0 |
小兵同学根据上述信息分析认为此溶液一定不是 溶液。为确定其成分,该同学对此溶液进行如下实验探究:
[提出假设]该溶液可能是 。
[实验验证]
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
|
28.某实验小组只用酚酞试液就可以鉴别稀盐酸、碳酸钠溶液和水三种试剂。他们填写的部分实验报告如下,请你帮助填写完整。
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量三种试剂于三支试管中,分别滴加2-3滴酚酞试液 |
一支试管中酚酞试液变红 色,另两支试管中无明显现象 |
|
|
② |
|
|
27.地球上的淡水资源是十分有限的。人类生产、生活造成的水体污染加剧了水资源危机。常州市的水资源十分丰富,但作为常州明珠的涌湖、长荡湖已受到不同程度污染。
(1)水体富营养化是常州市水环境的主要问题之一。水体富营养化是指水体中含氮、磷的化合物过多,这些化合物是水生植物生长、发育的养料。
①蛋白质是主要的含氮污染物,蛋白质在水中分解:蛋白质一氨基酸一氨(NH3),氨在微生物作用下,与溶解在水中的氧气反应,生成亚硝酸(HNO2)和水,反应的化学方程式为 ,弧硝酸进一步在微生物作用下与氧气反应生成硝酸,并以硝酸盐的形式作为水生植物的养料。
②含磷化合物主要来源于洗涤剂和不合理使用磷肥。洗涤剂中有一种成分的化学式为Na5PxOy,若P的化合价为+a,则a和x,y的关系是:a= 。
③白天受阳光照射,充足的养料使绿藻等水生植物迅速繁殖,水体变绿,光合作用的化学方程式是 。晚间由于污染物耗氧和水生植物的 作用,使水中的含氧量急剧下降,会 造成鱼类等水生动物因缺氧而死亡。另外,大量水生植物的残骸腐烂分解出有毒物质,使水质更加恶化。
(2)含酸、碱、重金属离子的工业废水也是重要的水体污染物。如果要处理某工厂产生的酸性污水,你建议用NaOH还是Ca(OH)2进行处理?,理由是:
26.(1)古代铜币表面绿色铜锈的主要成分是Cu2 (OH)2CO3,文物鉴定人员常用酸验法鉴别铜锈真伪;用细玻璃棒蘸取少许稀盐酸,涂擦在需要鉴别可疑铜锈的部位,若有气泡产生则初定为铜锈,反应的化学方程式为 。
(2)某厂采用联合法生产硫酸铜、硫酸亚铁作饲料添加剂,主要步骤如图l3-l2所示:
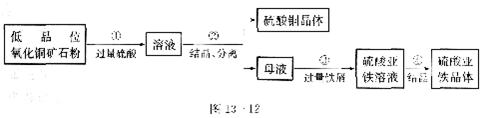
写出图中①、③反应的化学方程式:
①
③ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com