
4.我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球轨道,该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2 NH4ClO4===N2↑+Cl2↑+4H2O↑+2O2↑,请判断该反应的基本反应类型是
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
3.不能用燃着的木条鉴别的一组物质是
A.空气和氧气 B.氮气和二氧化碳
C.聚乙烯塑料和聚氯乙烯塑料 D.羊毛和化纤布料
2.下列物质中属于氧化物的是
A.高锰酸钾 B.臭氧(O3) C.干冰 D.矿泉水
1.绿色能源不会产生或残留对环境造成污染的物质,下列能源中不能称为绿色能源的是
A.铅蓄电池 B.氢能 C.风能 D.太阳能
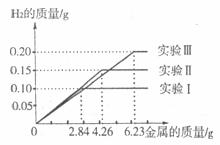
26.(10分)某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图像:
试回答(计算结果精确到0. 1%):
(1)写出实验中有关的化学方程式:
(2)实验I中铁参加反应的质量为 。
(3)稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少。
25.(13分)某化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素。实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10 g;所用HCl的质量分数为9.125%、18.25%,每次实验HCl的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1 g/em3;大理石中杂质不与盐酸反应)。
(1)反应原理:实验中的化学方程式 。
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关。
(3)实验设计与实施:完成以下实验设计方案并实验。
|
实验 编号 |
T/℃ |
大理石 规格 |
HCl的 质量分数 |
完全反应 的时间/s |
实验目的 |
|
① |
25 |
粗颗粒 |
18.25% |
160 |
(I)实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响。 (II)实验①和③探究温度对该反应剧烈程度的影响。 (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响。 |
|
② |
|
|
|
210 |
|
|
③ |
35 |
粗颗粒 |
18.25% |
60 |
|
|
④ |
|
|
|
100 |
(4)实验结论: 。
(5)绘制图像:实验①中CO2质量随时间变化的关系如下图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化)。
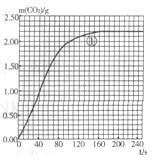
说明:可以用铅笔画曲线。
24.(7分)CO2是目前大气中含量最高的一种温室气体,科学家正在研究分离出空气中的CO2,然后在催化剂作用下将CO2和H2反应合成汽油、甲醇等有机物。请回答以下问题:
(1)实验室中可选用制取氢气的装置 。
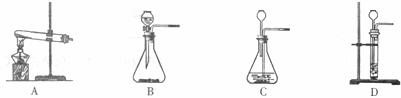
简述实验中将锌粒加入容器的方法是
。
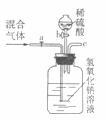
(2)某同学设计下图装置分离CO2和CO。实验开始时关闭活塞b,打开活塞a,让混合气体从导管口进入,所得纯净气体从导管c逸出(假设完全反应),此时逸出的气体是 。混合气体通人完毕后,再关闭活塞a,打开活塞b,使分液漏斗中的稀硫酸进入广口瓶,此时逸出的气体是 。
23.(8分)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
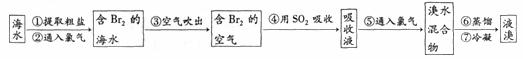
I .海水提溴。从海水中提取的溴约占世界溴产量的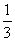 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:
试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是 。
Ⅱ .食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨
水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加人食盐细粒充分搅拌,
控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析
出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表:
|
|
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
碳酸氢铵 |
15.8 |
21.0 |
27.0 |
----- |
------ |
|
碳酸氢钠 |
8.1 |
9.6 |
11.1 |
12.7 |
------- |
|
氯化铵 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
请回答:
(1)碳酸氢铵的化学式是 。
(2)由上表分析过程②中能发生反应的原因是 。
(3)过程③中反应的化学方程式是 。
22.(10分)小梅同学学习了单质、氧化物、酸、碱、盐 性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。铜及其化合物在工业上有重要的应用。借助网络图回答:
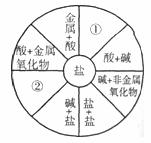
(1)写出用酸和碱 生产硫酸铜的化学方程式:
。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
① ;② 。
(3)根据网络图可制备物质。例如,某回收含铜电缆废料的工厂有下列制铜的方案:
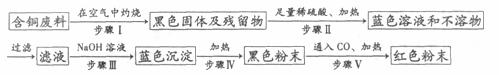
①写出下列步骤中的化学方程式:
步骤Ⅲ: 。
步骤V: 。 。
②上述方案中可能造成空气污染的步骤是 。 .
21.(12分)生活中处处有化学,请根据所学化学知识填写下列空白:
(1)碘盐、含氟牙膏、高钙牛奶等物质中的“碘、氟、钙”是指 。
(2)潍坊市区家用燃气已由煤气(主要成分是CO和H2)更换为天然气,写出它们燃烧的3个化学方程式 。在相同温度和压强下,气体分子数与其体积成正比。
燃烧煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是 。
(3)三聚氰胺对人体有害。牛奶和奶粉等添加三聚氰胺(C3N6H6)以提高氮的含量的做法是违法的。三聚氰胺中氮元素的质量分数为 (精确到0.1%)。它可由以下反应制取:
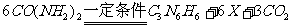 则X的化学式为 。
则X的化学式为 。
人体除必需蛋白质、无机盐和水外,还必需的营养素有 。 ,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com