
4.下列说法正确的是 ( )
A.在化学反应中某元素由化合态变为游离态,该元素一定被还原了
B.失电子难的原子获得电子的能力一定强
C.电子层结构相同的各种离子,它们半径随核电荷数的增加而减小
D.最外层电子数较少的金属元素,一定比最外层电子数较多的金属元素活泼性强
3.X、Y是元素周期表第ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是 ( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
2.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
1.下列措施不利于“蓝天工程”建设的是 ( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.加高烟囱,减少烟尘对周围环境的影响
C.实施绿化工程,防治扬尘污染
D.研制开发燃料电池汽车,消除机动车尾气污染
22、(8分)某校研究性学习课外环保小组对采集气体样品中所含污染气体CO的浓度进行测定,其方法与步骤如下:
①先使采集的气体样品2.00L缓缓通过含I2O5的加热管,发生反应:
CO + I2O5 → CO2 + I2
②将产生的I2升华,并由浓度为0.005mol•L―1的Na2S2O3溶液30.0mL完全吸收,此时发生反应:I2 + S2O32― → I― + S4O62―
③向②的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01mol•L―1的I2水滴定,耗去5.00mL的溶液恰好变色。
⑴操作③中,滴定终点时溶液由___________色变为_________色。若在用I2水滴定操作读数时,滴定前仰视将会导致测得的CO浓度_________。(填“偏高” 、“偏低” 、“不影响” )
⑵步骤①中由CO与I2O5反应生成I2的物质的量是 mol。
⑶该气体样品中CO的浓度为 mg•L―1
21、(12分)有A、B两种常见化合物组成混合物,其焰色反应均为黄色,其相互转化关系如图(其它物质均略去)。
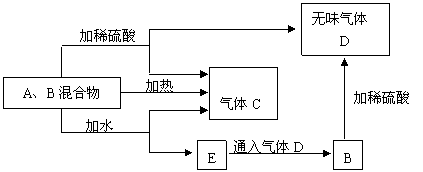
根据以上关系,回答下列问题:
⑴写出电子式:
A ,D 。
⑵写出混合物中加水反应的化学方程式:
⑶加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为 ∶ (填数字)。
20、(8分)某种含有少量氧化纳的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用下图装置测定混合物中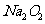 的质量分数,每隔相同时间读得电子天平的数据如表:
的质量分数,每隔相同时间读得电子天平的数据如表:
(1)
|
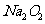 和
和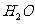 反应的离子方程式:
反应的离子方程式:
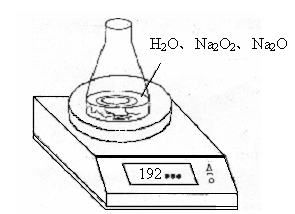
(2)计算过氧化钠质量分数时,必需的数据是 。不必做第6次读数的原因是 。
(3)测定上述样品(1.560g)中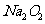 质量分数的另一种方案,其操作流程如下:
质量分数的另一种方案,其操作流程如下:
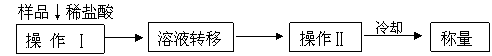
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③在转移溶液时,如溶液转移不完全,则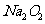 质量分数的测定结果 (填“偏大”、“偏小”或“不变”
)
质量分数的测定结果 (填“偏大”、“偏小”或“不变”
)
19、(10分)在用固体碳酸钠配制500mL 0.1mol/L碳酸钠溶液时,所用到的仪器除天平(含砝码)、烧杯、玻璃棒、胶头滴管外,还需要的仪器是: ;
下述因素使配成的溶液浓度与指定配制浓度相比是:
①偏高 ②偏低 ③无影响
(1).称量时在托盘天平两边的托盘上放两张大小相同的白纸,然后称取所需碳酸钠固体,倒入烧杯中,用适量蒸馏水溶解_______。(填序号,下同)
(2).称量时当砝码总和为4g,游码在刻度尺上的读数为0.4g时,天平达到平衡,配制后发现砝码和药品放颠倒了_________。
(3).溶解碳酸钠时,因加水太多,致使洗涤时用水太少或被迫减少洗涤次数_____。
(4).溶解碳酸钠所用烧杯不洁净,附有酸性物质________。
(5).加蒸馏水时,不慎超过了刻度,又用胶头滴管吸出 ______。
(6).定容时俯视观察液面___________。
(7).容量瓶用蒸馏水洗净后,未经干燥即用来配溶液___________。
(8).若所称的碳酸钠中含十水碳酸钠________。
18、(8分) 磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出x kJ的热量。
⑴.通过计算确定反应产物的组成(用化学式表示)是 ,
其相应的质量为___ _。
⑵.已知单质磷的燃烧热为y kJ /mol,则1mol P与O2反应生成固态P2O3 的反应热△H = ________________。
⑶.写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
17、(6分)“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:
KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为 。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为
(3)反应中被氧化的元素为
(4)H2O2被称为“绿色氧化剂”的理由是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com