
12.在硫酸镁、硫酸铝两种物质组成的混合溶液100mL中,SO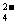 物质的量浓度为0.20mol/L,加入0.50mol/L NaOH溶液到生成的白色沉淀恰好不再溶解为止,消耗NaOH溶液的体积为100mL,过滤后所得滤液中AlO
物质的量浓度为0.20mol/L,加入0.50mol/L NaOH溶液到生成的白色沉淀恰好不再溶解为止,消耗NaOH溶液的体积为100mL,过滤后所得滤液中AlO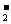 物质的量浓度为(设混合后总体积为200mL)(
)
物质的量浓度为(设混合后总体积为200mL)(
)
A.0.025mol/L B.0.050mol/L C.0.10mol/L D.0.25mol/L
第二卷(非选择题,共11题180分)
11.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是 ( )
A.HA与HB一定均为弱酸
B.若V1>V2,则说明HA的酸性比HB的酸性强
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两酸溶液等体积混合,混合溶液的pH一定等于2
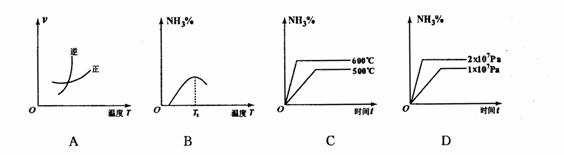
10. 工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)
2NH3(g)反应的图象中,错误的是 (
)
工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)
2NH3(g)反应的图象中,错误的是 (
)
9.已知五种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是 ( )
A.L与Q形成的化合物属于共价化合物
B.L、M的单质与稀盐酸反应速率:M>L
C.T、Q的氢化物常温常压下均为无色气体
D.M的最高价氧化物的水化物具有两性
8.下列叙述或表示正确的是 ( )
A.短周期元素离子X2+和Y2-,具有相同的电子层结构,则X2+离子半径比Y2-离子半径大
B.在4Fe(OH)2+O2+2H2O=4Fe(OH)3的反应中,转移电子数目为2NA
C.通过电解池装置可能实现此反应:Cu+2H+=Cu2++H2↑
D.氢氧化钠溶液与碳酸氢钠溶液反应的离子方程式:HCO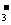 +OH-=H2+CO2↑
+OH-=H2+CO2↑
7.下表中实验操作能达到实验目的的是 ( )
|
选 项 |
实验操作 |
实验目的 |
|
A |
向甲酸钠溶液中加新制的Cu(OH)2并加热 |
确定甲酸钠中含有醛基 |
|
B |
向苯酚的稀溶液中滴加稀溴水 |
制备三溴苯酚 |
|
C |
向酒精和醋酸的混合液中加入金属钠 |
确定酒精中混有醋酸 |
|
D |
将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
检验水解产物中的溴离子 |
6.下列物质性质的比较,其中正确的是 ( )
A.金属性:由锌、铜、稀硫酸组成的原电池,负极的金属还原性弱
B.熔、沸点:碱金属与卤素单质的熔、沸点均随原子序数的增大而升高
C.氧化性:K+>Na+>Li+
D.热稳定性:Na2CO3>NaHCO3>H2CO3
25.(10分)将22.4g铜粉与氧化铁混合物粉末加入浓度为1mol/L的硫酸溶液中进行反应。
(1) 若混合粉末恰好全部溶解,消耗硫酸溶液的体积为VL,求V的最小值。
(2) 若硫酸溶液过量,反应后溶液的体积为1L,测得此溶液中Fe2+离子浓度为0.l mol/L。求此混合物中铜粉的质量。
24.(10分)100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH·2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同温度下每100g氢氧化钾饱和溶液中氢氧化钾的质量为:(已知电子的电量为1.6×10-19c)
|
温度/℃ |
0 |
10 |
20 |
30 |
|
KOH/g |
49.2 |
50.8 |
52.8 |
55.8 |
(1)被电解的水的物质的量为_ mol.;
(2)计算电解后剩余溶液的质量分数;
(3)温度T为 。(填范围)
23.(10分)已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
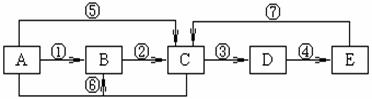
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。由此可知:E的化学式为 。
当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目,即G和CO2互称为等电子体)和一种无色无味的液体H,写出F分解生成G+H的化学方程式 _____ 。
(2)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,D被冰水冷却时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com