
15.(8分)科学探究是非常注意方法和原则的。往往采用控制条件不变、每次只有一个变量
的方式来探究事物变化的规律。
已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:分别为XY、X2Y或X3Y。请设计实验(实验装置任选)来确定C的化学式,YC简述实验过程,分析说明结论。
实验过程:
结论及分析:
①若实验结果是: ,则生成物C的化学式为XY。
判断的依据是:
。
②若实验结果是: ,则生成物C的化学式为X2Y。
判断的依据是:
。
14.(0分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g-0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO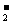 +xI-+yH+=2NO↑+I2+zH2O,请回答下列问题:
+xI-+yH+=2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,根据是 ;
y的数值是 ,根据是 。
(2)根据上述反应,可用化学试纸的生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
13.(9分)某淡黄色粉末A在加热的条件下可与某金属B反应产生黑色固体C、A又能在空气中燃烧产生无色气体D。将1mol黑色固体C放入足量热浓硝酸中,固体C完全溶解,反应中有10mol电子发生转移,并只产生一种气体E为红棕色。向足量D的饱和溶液中通入0.1mol气体F,产生淡黄色粉末A4.8g。请回答:
(1)写出下列物质的化学式:
A C D F
(2)气体F能否使红棕色气体F褪色? ,判断的根据是:
。
(3)1mol固体C与足量热浓硝酸反应,能产生气体E的体积(标况)是: 。
12.(8分)有X、Y、Z、W四种短周期元素,已知:
①Z+与W的气态氢化物分子具有相同的电子数;X2-、Y-与Y的气态氢化物分子具有相同的电子数;
②X单质在空气中燃烧产生气体R;
③Y的气态氢化物与W的气态氢化物相遇时有白烟生成。
请回答:
(1)Z的单质在空气中燃烧产物的电子式为: 。
(2)实验室制取W的气态氢化物的反应方程式为:
。
(3)向Y单质的水溶液中通入过量气体R的现象为: ,
反应的离子方程式为 。
11.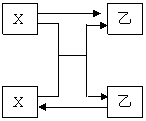 (6分)X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互之间有如右图所示的转化关系(反应条件均
(6分)X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互之间有如右图所示的转化关系(反应条件均
已略去),请写出下述三种情况下X由与甲反
应化学方程式。
(1)若X、Y均为气态单质,甲为无色液体:
。
(2)若X、Y均为固态非金属单质:
。
(3)若X为金属单质,甲为磁铁矿的主要成分:
。
9.某溶液中含有HCO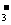 、SO
、SO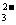 、CO
、CO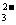 、CH2COO-等4种阴离子。若向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是 ( )
、CH2COO-等4种阴离子。若向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.CH3COO- B.SO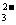 C.CO
C.CO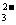 D.HCO
D.HCO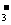
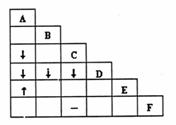 10.有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴
10.有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴
别它们,各取少量溶液进行两两混合,实验结果
如右表所示。表中“↓”表示生成沉淀,“↑”表
示生成气体,“-”表示观察不到明显现象,空格
表示实验未做。试推断其中F是 ( )
A.Na2CO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.NaHCO3溶液
第II卷
8.已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是 ( )
A.上述实验证明氧化性:MnO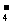 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
7.某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=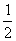 C(Na+)=
C(Na+)=
c(SO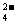 ),则其溶质可能是 ( )
),则其溶质可能是 ( )
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、KCl、K2SO4 D.KCl、K2SO4、Na2SO4
6.下列离子在溶液中能大量共存的是 ( )
A.Na+、K+、ClO-、I- B.Cl-、NO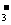 、Fe2+、Na+
、Fe2+、Na+
C.K+、Ba2+、OH-、SO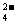 D.Ba2+、NH
D.Ba2+、NH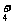 、Br-、OH-
、Br-、OH-
5.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4L Cl2与HCl的混合气体中含有的氯原子总数为3NA
B.0.5molI-被氧化时失去的电子数为0.5NA
C.在0℃,压强为101×105Pa时,11.2L SO3所含原子数目为2NA
D.常温常压下,48gO3含有氧原子数为3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com