
7.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
6.下列含有非极性键的共价化合物是
A.HCl B.Na2O2 C.C2H2 D.CH4
5.下列有机物命名正确的是
A、2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
C、 间二甲苯 D.
间二甲苯 D.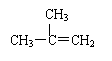 2-甲基-2-丙烯
2-甲基-2-丙烯
4.下列不符合当今化学研究方向的是
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
3.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为
A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.以下化学用语正确的是
A.乙烯的结构简式CH2CH2 B.乙酸的分子式C2H4O2
C.明矾的化学式KAlSO4·12H2O D.氯化钠的电子式Na
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B。用液氢替代汽油 C.开发风能 D.开发地热
18.(8分)工业采取氨氧化法来制取硝酸,主要反应为:
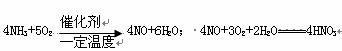
请回答下列问题:
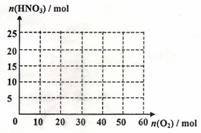
(1)设空气中氧气的体积分数为0.20,氮气体积分数为0.80,为使NH3恰好完全氧化为一氧化氮,氨一空气混合物中氨的体积分数为 (保留2位小数)。
(2)若将20.0mol的NH3和一定量纯净的氧气充分反应后,再转化为HNO3。
①在右图中画出生成HNO3的物质的量n(HNO3)和反应消耗的氧气的物质的量n(O2)关系的理论曲线。
②写出当25.0mol≤n(C2)≤40.0mol时,n(HNO3)和n(O2)的关系式:
。
17.(10分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
|
②粗硅与干燥的Cl2反应制得SiCl4:Si+2Cl2 SiCl4
③SiCl4被过量H2在1000℃-1100℃时还原制得纯硅。
某同学从资料中查知:SiCl4熔点为-70℃,沸点57.6℃,在潮湿的空气中能发生水解反
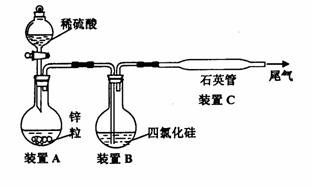 应。该同学设计了以下制取纯硅的实验装置(热源及夹持装置略去)。
应。该同学设计了以下制取纯硅的实验装置(热源及夹持装置略去)。
请回答下列问题:
(1)为使SiCl4从装置B中逸出与H2充分混合,应采取的措施是:
。
(2)装置C不能采用普通玻璃管的原因是 ,
石英的化学式是 。
(3)如果从A中直接快速向B中通入气体,可能观察到的现象是
。
(4)为防止空气污染,含有SiCl4的尾气要通入盛有 溶液的烧杯中,反应的化学方程式为: 。
(5)为保证制备纯硅实验的成功,英才操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是:
。
16.(11分)某研究性学习小组为测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,设计了如下实验步骤:
①准确称量样品质量ag;
②向样品中加入10mL 6mol·L-1的盐酸,样品溶解后再加入蒸馏水配成100mL溶液;
③向上述溶液中加入3mL氯水,搅拌使其反应完全;
④加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后干燥;
⑥将沉淀移至坩埚中,灼烧、冷却、称重,并反复操作多次至固体完全反应。
试回答下列问题:
(1)写出步骤④中产生沉淀的离子方程式:
。
(2)确认步骤④沉淀已经完全的方法是
。
(3)洗涤沉淀的操作方法是
;
检验沉淀是否洗净的方法是
。
(4)在步骤⑥中,判断固体反应完全的方法是: 。
(5)若空坩埚质量为bg,充分灼烧固体完全反应后,剩余固体和坩埚的总质量为cg,则样品中铁元素的质量分数是 ×100%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com