
9.温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤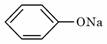 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑥⑤ B. ①③⑥④②⑤
C. ③②①⑥④⑤ D. ⑤⑥②④①③
8.能正确表示下列反应的化学方程式是
A.黄铁矿煅炼:2FeS2+5O2 FeO+4SO2
FeO+4SO2
B.石英与石灰石共熔:SiO2+CaO CaSiO3
CaSiO3
C.氨的催化氧化:4NH3+5O2 4NO+6H2O
4NO+6H2O
D.氯气与石灰乳反应:2Cl2+2Ca(OH) 2=CaCl2+CaClO2+2H2O
7.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10NA
6.下列做法正确的是
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
0.075 mol / LKMnO4 溶液处理,发生反应如下:
8MnO- 4 +5Cu2S + 44H + ==10Cu 2+ + 5SO2+8Mn 2+ +22H2O
6MnO- 4 +5CuS + 28H + ==5Cu 2+ + 5SO2+6Mn 2+ +14H2O
反应后煮沸溶液,赶尽 SO2,剩余的 KMnO4 恰好与 350mL 0.1 mol/ L (NH4)2Fe (SO4)2
溶液完全反应。
(1) 配平 KMnO4 与(NH4)2Fe (SO4)2 反应的离子方程式
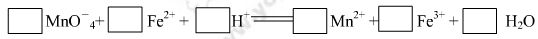
(2)KMnO4 溶液与混合物反应后,剩余 KMnO4 的物质的量为_________ mol.
(3)欲配制 500mL0.1 mol / Fe 2+ 溶液,需称取(NH4)2Fe (SO4)2·6H2O (M=392g/mol)
的质量为 __________g。
(4)混合物中 Cu2S的质量分数为 __________。
29.(14分)2gCu2S和 CuS的混合物在酸性溶液中用 400 mL
57.6℃)和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为 _____________________。
(3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去):
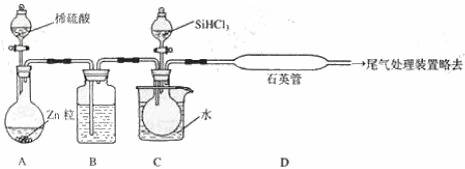
①装置 B中的试剂是 ______________。
装置 C中的烧瓶需要加热,其目的是 _____________________。
②反应一段时间后,装置 D中观察到的现象是 _________________,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以
及____________________ 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________ 。
a. 碘水 b.氯水 c.NaOH溶液
b. d.KSCN溶液 e.Na2SO3 溶液
28.(19分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤
如下:
① 高温下用碳还原二氧化硅制得粗硅
300℃
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si +3HCl =====SiHCl3+H2
③SiHCl3 与过量 H2 在 1000~1100℃反应制得纯硅
已知 SiHCl3,能与 H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 __________________。
(2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点
27.(19分)碱存在下,卤代烃与醇反应生成醚(R-O-R‘):
KOH
R-X + R‘OH ---→ R-O-R ’ +HX
室温
化合物 A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
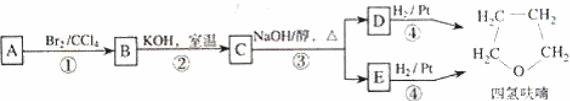
请回答下列问题:
(1)1molA和 1molH2 在一定条件下恰好反应,生成饱和一元醇 Y,Y中碳元素的质量分数约为 65%,则 Y的分子式为 _____________________。
A分子中所含官能团的名称是 _________________。
A的结构简式为 _________________。
(2)第①②步反应类型分别为① ______________② ________________。
(3)化合物 B具有的化学性质(填写字母代号)是 __________________。
a. 可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
b. 可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出 C、D和 E的结构简式:
C ______________、D________________和 E __________________。
(5)写出化合物 C与 NaOH水溶液反应的化学方程式:
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:_________________________.
26.(14分)中学化学中几种常见物质的转化关系如下:
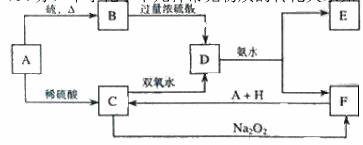
将 D溶液滴入沸水中可得到以 F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中 F粒子直径大小的范围:___________________。
(2)A、B、H的化学式:A __________、B ___________、H ___________。
(3)①H2O2 分子的电子式:________________ 。
②写出 C的酸性溶液与双氧水反应的离子方程式:____________________________。
(4)写出鉴定 E中阳离子的实验方法和现象:
(5)在 C溶液中加入与 C等物质的量的 Na2O2,恰好使 C转化为 F,写出该反应的离子方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com