
21.(8分)⑴取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)- c(M+)= mol/L,
c(H+)- c(MOH)= mol/L。
⑵如果取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
20.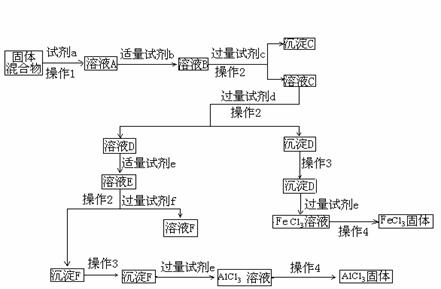 (14分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
(14分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
回答下列问题:
(1) 写出下列试剂的名称:试剂c___________, 试剂d__________,试剂f ,
(2) 操作3是 ,具体操作是 ;
操作4是 ,操作时应注意的问题是 ;
(3) 加入试剂b的目的是_________________________________________ ,判断试剂b适量的方法是________________________________________________________________。
(4) 由溶液D转变成溶液E的操作中,判断加入的试剂e适量的依据是_______________________________________________________________________。
(5) 溶液E中的溶质有:_________________________________。其中杂质是否要另加试剂除去__________(填“是”或“否”),原因是_______________________________;
(6) 有同学认为上述实验中最后得到AlCl3和FeCl3固体的步骤不科学,他的理由是:______________________________________________________________________。
19.(8分)
(1)指出在使用下列仪器(已净)或用品的第一步操作:
|
石蕊试纸检验气体 |
容量瓶 |
集气瓶收集氯化氢 |
|
|
|
|
(2)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,填空并请回答下列问题:
|
应称量NaOH的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
用托盘天平称取固体样品时(1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g。
下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体置露在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
18.某铜铝合金4.92g完全溶于浓硝酸,若反应中硝酸被还原只产生4.032L的NO2气体和0.672L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.00g B.3.12g C.5.88g D.7.44g
第二卷(共78分)
17.2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
[CH]n+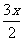 I2→[CH]
I2→[CH]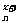 +xI
+xI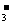
则聚乙炔的碳链结构片段和下列叙述正确的是
①-C≡C-C≡C-C≡C- ②-C=C-C=C-C=C-
③=C=C=C=C=C=C= ④-C=C-C≡C-C=C-C≡C-
⑤这种可导电的塑料是一种纯净物,有固定的熔、沸点
⑥掺杂后的聚乙炔之所以能导电,是因为它具有类似盐的结构
⑦聚乙炔和碘的掺杂反应中,聚乙炔被还原
⑧聚乙炔经掺杂反应后,分子内碳链结构未发生变化
A ①⑤ B ②⑧ C ④⑥ D ③⑦
16.已知某溶液中只存在OH-、H+、CH3COO-、 Na+四种离子,若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为[c(NaOH)、c(CH3COOH)]及混合前酸中c(H+)和碱中c(OH-)的关系是
A 大于、小于 B 小于、大于 C小于、小于 D 大于、大于
15.某学生正在实验室做气体发生、洗涤、干燥、收集(不考虑尾气处理)实验,
装置如下图所示:
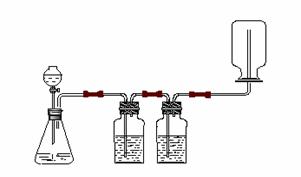
请你判断他所做的实验是
A 锌和盐酸发生氢气
B 二氧化锰和浓盐酸生成氯气
C 碳酸钙和盐酸生成二氧化碳
D 氯化钠和浓硫酸生成氯化氢
14.在一定条件下,下列药物的主要成分都能发生①取代②加成③水解④中和 四种反应的
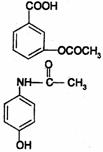 是 ( )
是 ( )
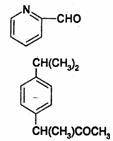
A.维生素 B.阿司匹林
C.芬必得 D.扑热息痛
13.根据离子晶体的晶体结构,判断错误的化学式是 ( )
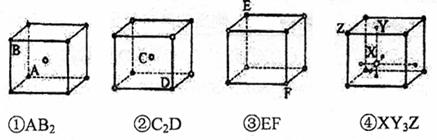
A ① B ② C ③ D ④
12.下列各选项所述的两个量,前者一定大于后者的是
① F2和Br2的沸点 ②纯水在25℃和80℃时的pH值
③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量
④25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点
⑦H-和H+离子半径
⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A ①②⑥ B ①②③⑤ C ⑤⑥⑦ D ②⑦⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com