
30.有机物和可用作塑料增塑剂或涂料中的溶剂。它们的分子量相等,可用以下方法合成
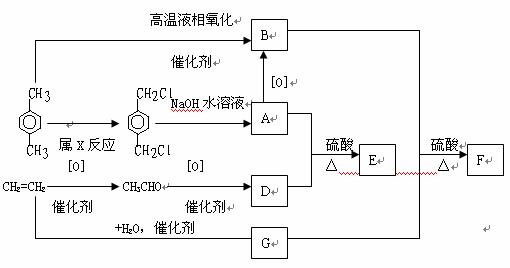
请写出:有机物的名称:A .B 化学方程式:A+D→E
B+G→F 反应的类型及条件:类型 ,条件 E和F的相互关系属 (多选扣分)①同系物②同分异构③同一物质④同一类物质
29.化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过
(1)用臭氧处理,(2)在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收一摩尔氢气生成醇D(C4H10O),用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8)。已知:
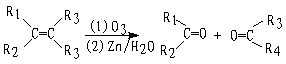 注:R1.R3可为H或其它烃基
注:R1.R3可为H或其它烃基
试根据已知信息写出下列物质的结构简式:
A B2 C E
28.含苯酚的工业废水处理的流程图如下图:

(1)上述流程里,设备Ⅰ中进行的是 操作(填写操作名称)。实验室里这一步操作可以用 进行(填写仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是 ,由设备Ⅲ进入设备Ⅳ的物质B是 。
(3)在设备Ⅲ中发生反应的化学方程式为: 。(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH.H2O和 。通过 操作(填写操作名称),可以使产物相互分离。
(5)上图中,能循环使用的物质是C6H6.CaO. . 。
27.某学生试图用电解法根据电极上析出的物质的量质量来验证阿佛加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如右图:②在电流强度为I安培,通电时间为t秒钏后,精确测得某电极上析出的铜的质量为m克。试回答:
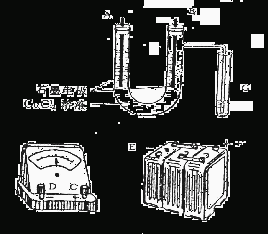
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接 ,C接 , 接F。实验线路中的电流方向为 → → →C→ →
(2)写出B电极上发生反应的离子方程式 G试管中淀粉KI溶液变化的现象为 ;相应的离子方程式是 。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库仑。试列出阿佛加德罗常数的计算表达式:NA
26.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+≒2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K= 当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右.向左.不)。(2)上述反应的正向反应速度和I-Fe3+的浓度关系为:υ=κC C
C (κ为常数)
(κ为常数)
|
|
C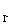 (mol/L) (mol/L) |
C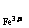 (mol/L) (mol/L) |
(mol/L·s) |
|
(1) |
0.20 |
0.80 |
0.032κ |
|
(2) |
0.60 |
0.40 |
0.144κ |
|
(3) |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算得知:在υ=κC C
C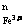 中。M.n的值为
中。M.n的值为
A.m=1,n=1 B. m=1,n=2 C. m=2,n=1 D. m=2,n=2
I-浓度对充应速度的影响 Fe3+浓度对反应速度的影响。(选填:小于.大于.等于)
25.设想你去某外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
|
单质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
熔点(℃ |
-150 |
550 |
160 |
210 |
-50 |
370 |
450 |
300 |
260 |
250 |
|
与水反应 |
|
∨ |
|
|
|
∨ |
∨ |
∨ |
|
|
|
与酸反应 |
|
∨ |
|
∨ |
|
∨ |
∨ |
∨ |
|
∨ |
|
与氧气反应 |
|
∨ |
∨ |
∨ |
|
∨ |
∨ |
∨ |
∨ |
∨ |
|
不发生化学反应 |
∨ |
|
|
|
∨ |
|
|
|
|
|
|
相对于A元素的原子质量 |
1.0 |
8.0 |
15.6 |
17.1 |
23.8 |
31.8 |
20.0 |
29.6 |
3.9 |
18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24.某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+.Ag+.Fe3+.Cl-.OH-.NO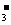 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 . . 。
乙厂的废水中含有另外三种离子。如果加一定量 (选填:活性炭.硫酸亚铁.铁粉)。可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
23.在热的稀硫酸溶液中溶解了11.4g FeSO4。当加入50mL 0.5mol/L KNO3溶液后,使其中Fe2+的全部转化成Fe3+,KNO3也反应完全,并有NXOY氮氧化物气体逸出。FeSO4 + KNO3 + H2SO4 →K2SO4 +Fe2(SO4)3+ NXOY+H2O (1)推算出X= Y= (2)配平该化学方程式(系数填写在上式方框内) (3)反应中氧化剂为 (4)用短线和箭头标出电子转移的方向和总数
22.由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。 则该混合气体中CO2H和CO的体积比为
A.29:8:13 B.22:1:14 C.13:8:29 D.26:16:57
第Ⅱ卷
21.把0.02mol/LHAc溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为
A.AC-)>C(Na+) B. C(HAc)>C(Ac-)
C.2C(H+)=C(Ac-)-C(HAc) D.C(HAc)+C(Ac-)=0.01mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com