
1、 胶体微粒的直径在1-100纳米(nm)之间(1nm=10-9m)。原子半径也可以用纳米为单位,则镁原子的半径为
A.0.16 nm B.1.60 nm C.16.00 nm D.160 nm
25(6分)、在40mL0.10mol/LBaCl2溶液中,加入过量0.10mol/LH2SO4溶液,使沉淀完全。将反应后的混合物过滤,取滤液的一半,在滤液中加入25mL0.22mol/LNaOH溶液至恰好呈中性。试计算加入H2SO4溶液的体积。(55ml)
26(14分)、已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,常温下能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。
现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)试写出Pb2O3与浓盐酸反应的化学方程式 。
(2)通过计算确定y与a、x的函数关系式为 。
(3)若两步反应中O2和Cl2的物质的量之比为5∶3,则此时剩余固体中含有的物质为
(写化学式) ,其物质的量之比为 。
24、法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,该过程被命名为烯烃复分解反应 。烯烃复分解反应可形象描述为交换舞伴。(如图)
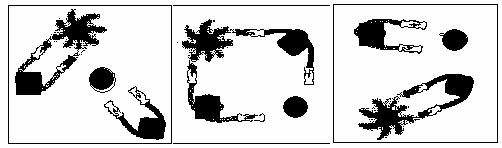
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后
两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个
新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻
找下一个烯烃分子,再次“交换舞伴”。 例如:烯烃复分解反应如下所示:
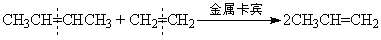
即从总效果看,是双键断裂后部分重新组合。
(1)C6H5CH2CH==CH2与CH2==M一定条件下反应,下列产物不可能存在的是 。
A. C6H5CH2CH==M B. CH2= CH2
C. C6H5CH2 CH2 C6H5 D. C6H5CH2CH==CH CH2 C6H5
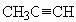 (2)炔烃也能发生此类反应,写出自身发生复分解反应的化学方程式:
(2)炔烃也能发生此类反应,写出自身发生复分解反应的化学方程式:
。
(3)烯烃复分解反应可以合成其他反应难以合成的物质,写出用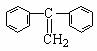 制取
制取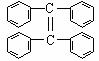 的化学方程式:
。
的化学方程式:
。
23、已知:J是一种日常生活中最常见的盐,D是淡黄色类粉末,H是常见轻金属单质,可用于飞机制造业,E是著名的“侯德榜工业制碱”的主要产品。它们的关系如下图,试回答问题:
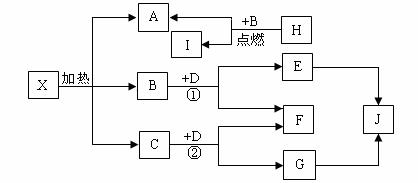
(1)J的化学式: 。
(2)写化学方程式① 、② 。
(3)X在医药上用作解酸剂,与盐酸作用时,若生成B的物质的量与消耗盐酸的物质的量之比为3∶8,则X的化学式为: 。
22、化学家泽维尔在用激光研究化学物质的结构方面有过突出贡献。他曾经用四氟化二碘做了下面实验:
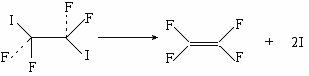
发现两个完全相同的C-I键是一先一后断裂的。则关于上述反应类型的判断中,正确的是 。
A. 取代反应 B. 加成反应 C. 消去反应 D. 加聚反应
21、过氧化氢(H2O2)俗名双氧水,一定条件下可以显示氧化性、还原性、酸性、漂白性等性质,医疗上可它用作外科消毒剂。根据信息回答:

(1)H2O2的电子式为 固态时H2O2属于 。
(2)双氧水加入酸性高锰酸钾溶液中,溶液的紫红色消褪。此时双氧水表现 。
(3)向含有酚酞的Na2CO3溶液中滴入足量的双氧水,溶液由红色褪至无色,再向该溶液中加入足量0.1mol/LNaOH溶液,溶液始终不再显红色,说明双氧水有 性。
(4)经测定H2O2为二元酸,其酸性比碳酸弱。试写出H2O2在水溶液中的电离方程式 。
20、A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大。A是非金属性最强的元素且A、D同主族;B、C、D同周期, B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水;E是第四周期主族元素。试回答:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较大的是 (填写离子符号)。
(2)元素C在元素周期表中的位置是:第 周期, 族。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的是 (填写化学式)。
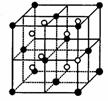
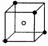
晶胞 晶胞的1/8
19、(1)有下列操作,其中设计和推理均正确的是 (选错倒扣分)。
A、用托盘天平称取10.32g干燥的NaCl固体
B、用10mL的量筒量取6.5mL浓盐酸
C、测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后跟标准比色卡比较
D、测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量
(2)工业上可以用S2Cl2作为橡胶的硫化剂,它不仅改变了橡胶热变粘、冷变硬的不良性能,还增加了橡胶的弹性。已知:S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:+138℃),具有强烈的窒息性,且易与水发生反应生成HCl、SO 2、H2SO4等物质。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置 (夹持装置、加热装置均已略去)。
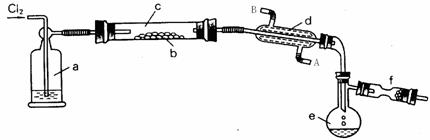
(1)装置a中应放的干燥剂为 ,装置c为何要水平放置? 。
(2)装置d的作用是 ,其中水的流动方向为 。
(3)装置f中应放的试剂为 ,其作用是 。
(4)已知S2Cl2的分子结构与H2O2相似,请写出其结构式 。
18、在标准状况下,将CO2和CO混合气体(密度为10/7g·L-1)充满一盛有足量Na2O2的密
闭容器中(容积为22.4L,固体体积忽略不计),用间断的点火花引发至充分反应,下列
对反应完全后容器里残留物的叙述正确的是:
A.有0.125molO2
B.有1molNa2CO3
C.有0. 5moCO
D.有0.25molNa2CO3
第二卷(非选择题,共78分)
17、将amol氢气和bmol乙烯混合,在一定条件下使它们部分反应生成cmol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为:
A.(3b+0.5a)mol B.(4b+0.5a)mol
C.(3b+1.5a)mol D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com