
21.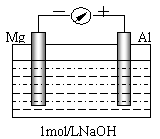 (10分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
(10分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
20.(10分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
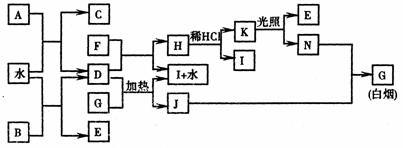 请按要求填空:
请按要求填空:
(1)B的电子式是 ,
K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是 ;
(4)单质F与D的反应在工业上有重要的用途,其化学方程式是 。
19.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B和E的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个离子反应方程式
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式:
。
18.(12分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
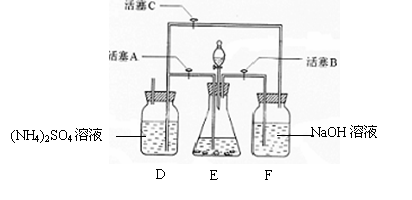
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
17.(8分)(1)试将下列配制l00mL 0.100mol/L的碳酸钠溶液的操作步骤按先后顺序排列为 (填数字序号)
①将一定质量的碳酸钠置一烧杯内,用少量水将其溶解。
②待溶液冷至室温后,将其完全转移到容量瓶内,摇匀。
③计算所需碳酸钠的质量,并用精密天平称取所需质量的碳酸钠。
④加水至容量瓶内,使凹液面最低点与容量瓶的刻度线相切,盖上塞子摇匀。
⑤检查容量瓶是否渗漏。
现若量取20.00mL该碳酸钠溶液,应选用的仪器是
(2) 根据观有中学化学知识,判断下列有关实验描述正确的是 (填序号)。
A. 红砖中氧化铁成分检验用到的试剂是盐酸和硫氰化钾溶液
B. 用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C. 中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D. 实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
E.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面
16.将2.4 g Fe 、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体V L(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6 g。则收集到的气体体积V值可为
A.0.986 B.1.12 C.3.36 D.6.72
第Ⅱ卷(选择题共86分 )
15.已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,下列说法正确的是
A.CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.在相同条件下,两溶液的pH大小为: CH3COONa< NaF
C.NaF溶液中:c(H+)+c(HF)= c(OH-)
D.两溶液相比较,NaF溶液中的离子总数较多
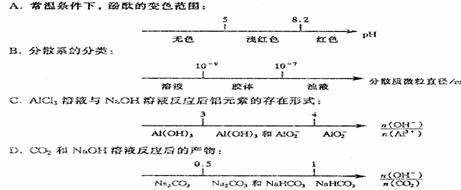
14.将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列化学知识正确的是
13.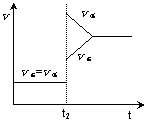 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
 2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是
2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.转化率增大,HI平衡浓度变小
D.改变条件前后,速率图像如右图
12.2005年7月以来,禽流感在全球发生并蔓延。“达菲”是瑞士罗氏公司研制的有效治疗人类禽流感的药物。达菲的主要合成原料是我国盛产的莽草酸。
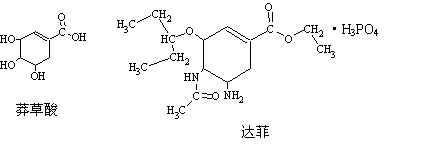
下列说法不正确的是
A.莽草酸可溶于水
B.莽草酸最多可和4molNaOH溶液反应
C.从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应
D.从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com