
11.下列有关化学反应的描述正确的是 ( )
A.将足量稀盐酸加到Mg、AlCl3、NaAlO2组成的固体混合物中,只能发生一种反应
B.把盛有等物质的量的一氧化氮和二氧化氮的混合气体的试管倒置于水槽中,最后剩
余气体理论上为原来气体体积的2/3
C.稀硝酸与铁反应时产物与反应物的量有关,当n(Fe):n(HNO3)≥3:8时产物为Fe3+
D.甘氨酸和(NH4)2s都既能与盐酸反应,又能与NaOH溶液反应且都有气体生成
10.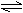 对于反应2SO2(g)+O2(g) 2SO3(g);△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是( )
对于反应2SO2(g)+O2(g) 2SO3(g);△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是( )
(0~t1;v正=v逆;t1时改变条件,t2时重新建立平衡。)
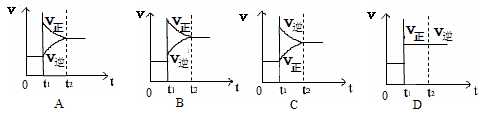
A.增加氧气的浓度 B.增大压强 C.升高温度 D.加入催化剂
9.下列离子方程式书写正确的是 ( )
|
B.硫酸亚铁加入到过氧化氢溶液中:Fe2++H2O2+2H+=Fe3++4H2O
C.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
Ca2++2HCO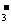 +2OH-=CaCO3↓+2H2O+CO
+2OH-=CaCO3↓+2H2O+CO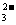
D.氯酸钾与浓盐酸制取少量氯气:6H++ClO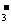 +5Cl-
+5Cl- 3Cl2↑+3H2O
8.若NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
A.常温常压下,22.4LN2和NO的混合气体所含的原子数为2NA
B.在反应CaO+3C CaC2+CO↑中,生成1
mol CO,转移的电子数为3NA
C.在10.6g Na2CO3晶体中,Na+和CO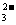 的数目比为2:1
的数目比为2:1
D.1mol
NH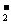 中含电子数为9NA
中含电子数为9NA
7.下列有关叙述中正确的是 ( )
A.胶体产生丁达尔效应是由胶粒的大小决定的
B.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
C.分子晶体溶于水时,一定不破坏共价键
D.同位素的质量数不同,物理性质不同,同位素的不同原子构成的单质化学性质也不相同
33.(8分)[化学-有机化学基础]
已知一个碳原子上同时连有两个羟基时,易发生如下转化:
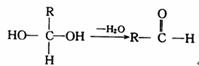
请根据下图回答:
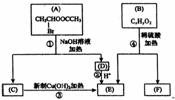
(1)反应③的类型是 。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2):n(H2O)=2:1,则B的分子式为 。
(3)F是制造电脑芯片中的高分子光阻剂的主要原料,F具有特点是:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(3)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G可能有_____种结构,写出苯环上一氯化代物只有三种同分异构体的结构简式 。
32. (8分)[化学-物质结构与性质]
(8分)[化学-物质结构与性质]
人类在使用金属的历史进程中,经历了铜、
铁、铝之后,第四种将被广泛应用的金属被科学
家预测为钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
(1)22Ti元素基态原子的价电子层排布为 ;
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
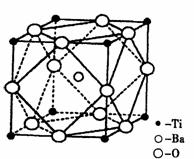
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。
偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种
晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的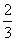 。
。
则绿色晶体配合物的化学式为 ,绿色晶体中含有化学键类型是 。
31.(8分)[化学-化学与技术]
某工厂以天然气、水蒸气和空气为原料合成氨,流程如下:
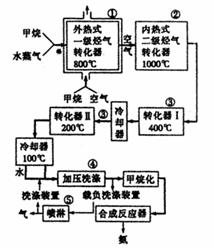
外热式一级烃气转化器,指以CH4为燃料在烃转化器外面加热使之维持800℃高温的工业装置。
内热式二级烃气转化器,指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(g)反应生成CO2和H2所需1000℃高温的装置。
在编号为①~⑤的反应器中发生如下反应:
a.CH4+2O2→CO2+2H2O b.CH4+H2O(g) →CO+3H2
c.2CH4+3H2O(g) →CO+CO2+7H2 d.K2CO3+CO2+H2O====2KHCO3
 e.CO+H2O CO2+H2(正反应为放热反应)f.2H2O+O2====2H2O
e.CO+H2O CO2+H2(正反应为放热反应)f.2H2O+O2====2H2O
完成下列问题:
(1)甲:反应a发生在编号为 的反应器中,它的作用是 。
乙:反应f发生在编号为 的反应器中,它的作用是 。
丙:属于制备合成氨原料气的反应有 (填编号),反应d的作用是 。
(2)为什么转化反应要分两步:第一步在400℃进进行,第二步在200℃时进行?
30.(14分)
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③在反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀的化学式是 。
(2)A是 ,B是 ,C是 ,
D是 ,E是 。(均填化学式)
(3)在A中逐滴滴入少量E时反应的离子方程式是 。
[选做部分]
29.(14分)氢氧化铜是一种常用试剂。如:利用氢氧化铜验证葡萄糖的还原性。
I.新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4滴~6滴,振荡即成。这样操作的目的是 。
下面是三个研究性学习小组分别从不同层面开展的探究性学习活动:
Ⅱ.研究性学习小组甲:对“葡萄糖与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑:他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想: 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣
方案3:称取红色沉ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的关系
方案4:取红色沉淀放大试管里,加入酸化的硝酸银溶液,观察是否有白色的银析出你认为合理的方案是 。
Ⅲ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述沉淀成分必然测定下列哪些物理量: 。
①通入氢气体积 ②反应前,红色沉淀和硬质试管的总质量
③反应后,红色固体和硬质试管的总质量 ④实验前,干燥管质量
⑤硬质试管质量 ⑥锌粒质量
⑦稀硫酸中含溶质的量 ⑧实验后,干燥管质量
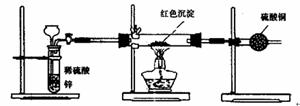
IV.研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的化学家”,绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求,他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案___________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com