
28.(14分)
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.64kJ的热量。
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
 N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++OH-
N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++OH-

 N2H5++H2O N2H62++OH- N2H5++H2O N2H4+H3O+
N2H5++H2O N2H62++OH- N2H5++H2O N2H4+H3O+
据此可得出的结论是 。
A.肼水解显酸性 B.肼在水中可电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和双氧水反应的热化学方程式 。
(3)已知H2O(1)=H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式 ,该反应的还原产物是 。
15.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是 ( )
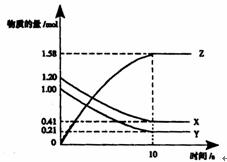 A.反应开始到10s,用Z表示的反
A.反应开始到10s,用Z表示的反
应速率为 0.158mol/(L·s)
B.反应开始到10s,X的物质的量
浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
 D.反应的化学方程式为:X(g()+Y(g) Z(g)
D.反应的化学方程式为:X(g()+Y(g) Z(g)
第Ⅱ卷(必做120分+选做32分,共152分)
卷上答题无效。
[必做部分]
14.下列描述中,不符合生产实际的是 ( )
A.在镀件上电镀锌,用锌作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.电解熔融的氧化铝制取金属铝,用铁作阳极
13.
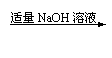 实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
 铝片
澄清溶液
白色沉淀
铝片
澄清溶液
白色沉淀
Al(NO3)3·9H2O
|
A.2Al+2OH-+2H2O=2AlO2-+3H2↑
B.2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O=NH3·H2O+ Al(OH)3↓
D.3H++ Al(OH)3=Al3++3H2O
12.NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.通常状况下,NH4+和NH2-各1mol含有的电子数均为10NA
B.标准状况下当氧气与氦气的原子数均为NA时,它们具有相同的体积
C.在100mL 1mol·L-1乙酸溶液中含乙酸的分子数为0.1NA
D.1mol乙醇在氧气中完全燃烧时,转移的电子数为2NA
11.下列除去杂质的方法正确的是 ( )
A.除去氮气中的少量氧气;通过灼热的氧化铜粉末,收集气体
B.除去二氧化碳中的少量氯化氢:通入饱和Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入足适量NaOH溶液,过滤
10.下列现象或应用中,不能用胶体知识解释的是 ( )
A.在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.用微波手术刀进行外科手术,可使刀口处的血液迅速凝固而减少失血
C.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
9.下列说法正确的是 ( )
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
8.科学家利用“同位素标记法”弄清了许多化学反应的详细过程。下列说法正确的是( )
A.用15N标记核苷酸弄清了细胞有分裂期染色体形态和数目的变化规律
B.用18O标记H2O和CO2有力地证明了CO2是合作用的原料
C.用14C标记CO2最终探明了CO2中碳元素在光合作用中的转移途径
D.用35S标记噬菌体的DNA并以此侵染细菌证明了DNA是遗传物质
28. (l2分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
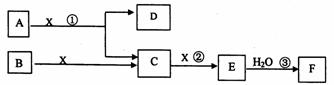
(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L·min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com