
24.(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐(能电离出两种阳离子和一种阴离子的盐,如KAl(SO)4、(NH4)4Fe(SO)4等)。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)。
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3︰1︰3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C.D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
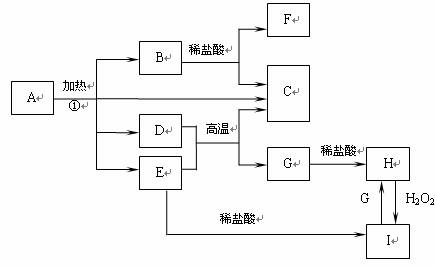
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
23.(12分)短周期主族元素A.B.C.D.E的原子的序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C.D是空气中含量最多的两种元素;D.E两种单质可以生成两种不同的离子化合物。
(1)写出E的单质与A.D两元素形成的常见化合物反应的离子方程式 ;
(2)由A.C.D三元素所形成的常见盐溶液呈 性(填“酸”、“中”、“碱”),其原因用离子方程式表示为 ;
(3)B的相对分子质量最小的氢化物的燃烧热为890.3kJ•mol-1,写出其燃烧的热化学方程式 ;
(4)X、Y是均由C.D两元素组成的化合物,且C.D在X、Y中的价态相同,某温度下相互转化时的量变关系如图所示:
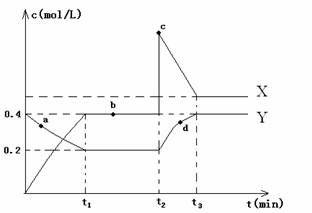
①X的化学式是 ;
②图中A.B.C.d四点中,表示反应处于平衡状态的是 ;
③该温度下,反应物Y转化为X的平衡常数为 ;
④反应进行到t2时,改变的条件可能是 。
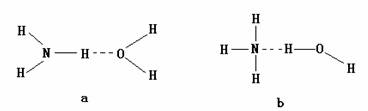
22.(12分)水分子之间存在一种叫氢键的作用力,使分子彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的四面体结构,通过氢键相互连接成庞大的晶体。
(1)冰属于 晶体,1mol冰中有 mol氢键;
(2)将1mol标况下的气体升温到120℃保持压强不变时,其体积变为32.2L。120℃的水蒸气中常含有(H2O)2,要确定(H2O)2的存在,可采用的方法是 ;
A.把1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.把1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.把水蒸气冷凝后,测水的pH值
D.把水蒸气冷凝后,测水中氢氧原子个数比
(3)水分子可电离出两种含相同电子数的微粒,这两种微粒的电子式为 、 ;
(4)通常双氧水(H2O2)与水相比,其沸点明显高于水,且粘稠度明显,其可能的主要原因是 .
A.相对分子质量比水大
B.分子间形成(H2O2)n,n值比较大
C.分子间的氢键作用比水分子更强烈
液态的双氧水(H2O2)具有酸性,与水一样也可以发生相同分子间的自偶电离,其电离方程式为 ;
(5)在冰的结构中除存在氢键作用外还存在范德华力作用(11 kJ/mol)。已知冰的升华热是51kJ/mol,则冰晶体中氢键的键能是 kJ/mol。
(6)氨气(NH3)极易溶于水的性质也与氢键有关。请判断氨气(NH3)溶于水后,形成的NH3•H2O的合理结构是(填代号)
21.(1)苹果汁是人们喜爱的饮料,由于饮料中含有Fe2+,现榨出的果汁在空气中会由淡绿色变成棕黄色。若榨汁时加入适量微生素C,可有效迟滞这种现象的发生,这说明维生素C具有 。
A.不活泼性 B.还原性
C.酸性 D.钝化作用
(2)某同学利用如图所示方法通过比较加入苹果汁和橙汁的体积多少来比较它们中维生素C含量的相对多少
①当烧杯中出现 现象时,停止加入苹果汁或橙汁。
②要得出正确结论,实验过程需要控制 和 条件。
③若要分别测定苹果汁和橙汁中维生素C的较准确含量(mg/L),应选用的玻璃仪器是 。
20.将Na2O2、HCl、AlCl3同时溶解在水中并充分反应,若所得溶液中只含有AlO2-、Na+、Cl-,而不含Al3+且忽略NaAlO2的水解,则Na2O2、HCl、AlCl3的物质的量之比可能为 ( )
A. 4:6:1 B. 6:8:1 C. 6:6:2 D. 4:6:3
|
19.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列判断正确的是 ( )
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD.D2
C.生成的氢气中只含有H2 D.以上判断都不正确
18.一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n<5,m<10=,广泛用于生活用水的净化和工业废水的处理。有关PAFC的介绍,正确的是 ( )
A.PAFC是一种无机高分子化合物
B.PAFC中铁元素显+2价
C.PAFC溶于水能电离出OH-,属于碱类物质
D.PAFC在强酸性和强碱溶液中均不能稳定存在
17.下列各组离子在碱性溶液中能大量共存,且无色透明,加酸酸化后溶液变色,但无沉淀,有气体生成的是 ( )
A.Fe2+、I-、ClO-、SO42- B. I-、K+、SO42- 、NO3-
C.Na+、SO32-、K+、SO42- D. Ca2+、Cl-、HCO 3- 、Na+
16.在硫酸铁溶液中加入a g铜,完全溶解后加入b g铁充分反应后得到c g残余物,且b < c。下列判断正确的是 ( )
A.最后得到的溶液中不含有Cu2+ B.残余固体可能为铁铜混合物
C.最后得到的溶液中只含Cu2+ D.残余固体一定是铜
15.五瓶失去标签的溶液,①(NH4)2SO4 ②Al2(SO4)3 ③FeCl3 ④Mg(NO3)2 ⑤Na2CO3,若不 用其他试剂,采用互滴的方法,可以将它们一一区分,区分出的顺序可能是 ( )
A.①②③④⑤⑥ B. ②⑤④③① C.③⑤②④① D.③⑤④②①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com