
21.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e- → NO↑+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
20.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、
Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在,Cl-可能存在 B.100mL溶液中含0.01mol CO32-
C.K+可能存在,Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷
19.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol
A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2mol
A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.1mol B和1mol C B.1mol A 1mol B和1mol He(不参加反应)
C.2mol C D.2mol A 3mol B和3mol C
18.常温下,下列各组数据中比值为2:1的是
A.Na2CO3溶液中c (Na+)与c (CO32-)之比
B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的盐酸中c (H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中,c (NH4+)与c (SO42-)之比
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比
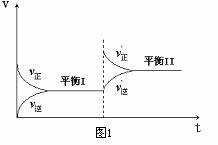
17.图1是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图,下列说法不符合该示意图的是
A.达到平衡时,正逆反应速率相等
B.增大反应物的浓度,反应由平衡I变化到平衡II
C.反应达到平衡I以后,减小反应物浓度,平衡移动到II
D.平衡II中反应速率比平衡I中的反应速率快。
16.在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)
 N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
A.相对平均分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
15.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH > 7
B.常温下,测得0.1 mol/L醋酸溶液的pH = 4
C.常温下,将pH = 1的醋酸溶液稀释1000倍,测得pH < 4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好
中和
14.常温时,将a1mL,b1mol/L 的CH3COOH溶液加入到a2mL,b2mol/L的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH=7,则b1>b2
13.下列有关的叙述,正确的是
A.Cl2 的水溶液能导电,但Cl2 是非电解质
B.0.01mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.常温下使pH为1的两份相同盐酸的pH均升高为2,需pH为13的NaOH
溶液与水的体积比为1∶11(体积变化忽略不计)
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
12.某温度下,反应H2
(g) +I2 (g) 2HI (g);△H<0,在带有活塞的密闭容器中达到平衡;下列说法中正确的是
2HI (g);△H<0,在带有活塞的密闭容器中达到平衡;下列说法中正确的是
A.体积不变,升温、正反应速率减小
B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氮气后,正反应速率将增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com