
21.(8分)我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。根据你所学的知识,试回答下列问题:
(1)大气污染物二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,试写出雨水中亚硫酸被氧化为硫酸的化学方程式__________________________。
(2)我市是受酸雨影响比较严重的城市,北仑电厂每年就要排放二氧化硫9.14万吨。目前该厂应用了国际上最成熟的石灰石-石膏湿法脱硫技术,使每年产生的二氧化硫成倍减少,“变”酸雨为石膏,达到了变废为宝的目的。请写出其中发生的反应中属于分解反应和化合反应的化学方程式各一个。
_______________________________ 、 ________________________________。
(3)结合你所学的化学知识,你认为减少酸雨产生的途径还可采用的措施是
___________________________________________________________。
★16.绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染。下列化学反应,不符合绿色化学概念的是
A.制Cu(NO3)2:2Cu+O2
 2CuO,CuO + 2HNO3 (稀)
= Cu(NO3)2+ H2O
2CuO,CuO + 2HNO3 (稀)
= Cu(NO3)2+ H2O
B.消除制硝酸工业尾气的氮氧化物污染
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
C.利用二氧化碳制造全降解塑料
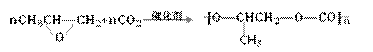
D.用铜与浓硫酸共热制硫酸铜: Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
★17.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为
A.O2 + 2H2O + 4e- = 4OH- B.O2 + 4H+ + 4e- = 2H2O
C.H2 + 2OH--2e-=2H2O D.H2-2e-= 2H+
★18.下列说法不正确的是
A.第三周期非金属元素最高价氧化物对应的水化物的酸性从左到右依次增强
B.锗可能和硅一样,也是良好的半导体材料
C.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
D.同周期元素(除稀有气体元素外)的原子半径从左到右逐渐减小
★19.25℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是
A.C(s)+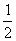 O2(g)=CO(g) △H=
-396 kJ·mol-1
O2(g)=CO(g) △H=
-396 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -896 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
D.CH3OH(l)+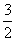 O2(g)=CO2(g)+2H2O(l) △H= +736kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H= +736kJ·mol-1
★20.酸碱质子理论认为,凡能给出质子(H+)的分子或离子都是酸;凡能接受质子的分子或离子都是碱。按此观点,下列粒子既属于酸又属于碱的是
①H2O ②ClO- ③Mg2+ ④CO32- ⑤NH4+ ⑥HSO3-
A.②③ B.①⑥ C.④⑥ D.⑤⑥
第II卷(共50分)
●16.下列说法不正确的是
A.第二周期N、O、F 对应的氢化物稳定性逐渐增强
B.硅是良好的半导体材料
C.第三周期金属元素最高价氧化物对应的水化物的碱性从左到右依次减弱
D.Li、Na、K的原子半径逐渐减小
●17.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
A.1/2 N2H4(g)+ 1/2 O2(g)= 1/2 N2(g)+ H2O(l) △H=+257kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
●18.能证明SO2具有漂白性的是
A.酸性KMnO4溶液中通入SO2气体后紫红色消失
B.在氢氧化钠溶液中加入酚酞溶液显红色,通入SO2气体后红色消失
C.品红溶液通入SO2气体后红色消失
D.溴水通入SO2气体后橙色消失
●19.下列关于氨和铵盐的叙述正确的是
A.氨气遇到氯化氢产生白雾
B.氨水可作化肥,但氨易挥发,常将氨转化为固态铵盐加以使用
C.铵盐能与碱反应放出氨气,能使蓝色石蕊试纸变红
D.氯化铵和氯化钠混合固体可通过溶解、过滤的方法加以分离
●20.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,现用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述正确的是
A.消耗的硝酸的量:③>①>②
B.③对环境造成的危害最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量不相等
15. 哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,有关说法正确的是
N2+3H2 2NH3
2NH3
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
14.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
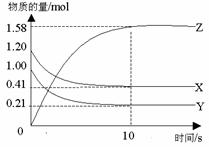
A.反应开始到10s,用Z表示的反应速率为 0.158mol·(L·s) -1
B.反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+
Y(g) Z(g)
Z(g)
13.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
12. 用石墨作电极电解滴有酚酞的饱和食盐水,下列说法正确的是
A.阳极上产生氢气 B.阴极附近溶液呈红色
C.阴极上产生氯气 D.溶液中的阳离子向阳极移动
11.将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是
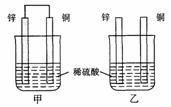
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
10.共价键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,下列晶体中,含有上述两种相互作用的是
A.石英 B.金刚石 C.冰 D.氯化钠
9.以下关于元素周期表的结构叙述正确的是
A.元素周期表有七个主族,八个副族
B.元素周期表有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.第三主族位于元素周期表的第三列(从左往右)
D.零族位于元素周期表的第18列(从左往右)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com