
26. (10分)在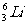 、
、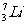 、
、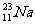 、
、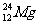 、
、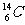 、
、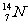 中
中
(1)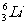 和
和 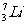 互称
,它们的化学性质
;
互称
,它们的化学性质
;
(2)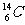 和
和 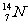 的
相等;
的
相等;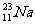 和
和 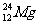 的
相等;
的
相等;
(3)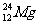 的电子所占据的电子层中,能量最高的是
层(填符号)。
的电子所占据的电子层中,能量最高的是
层(填符号)。
25. 在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是 ( )
A.0.1mol.L-1.min-1 B.0.2mol.L-1.min-1
C.0.3mol.L-1.min-1 D.0.6mol.L-1.min-1
24.可逆反应2SO2 + O2
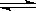 2SO3达到平衡的标志是
( )
2SO3达到平衡的标志是
( )
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.只有①
23.可逆反应N2+3H2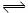 2NH3已达平衡,再经过t秒后,测得正反应速率v(N2)=0.6 mol/(L· s)此时,v(正)和v(逆)的关系是 ( )
2NH3已达平衡,再经过t秒后,测得正反应速率v(N2)=0.6 mol/(L· s)此时,v(正)和v(逆)的关系是 ( )
A.大于 B.小于 C.等于 D.无法确定
22.下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入适量空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
21.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是 ( )
A.10℃ 20mL 3mol/L的盐酸溶液 B.20℃ 30mL 2mol/L的盐酸溶液
C.20℃ 20mL 2mol/L的盐酸溶液 D.20℃ 10mL 4mol/L的盐酸溶液
20.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是 ( )
A.升高温度 B.加入适量的水
C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
19.在反应2SO2+O2  2SO3中,最初加入的O2为18O2,最终含有18O的物质有 (
)
2SO3中,最初加入的O2为18O2,最终含有18O的物质有 (
)
A.SO2 B.SO2 O2 SO3 C.O2 SO3 D.SO2 SO3
18.已知空气――锌电池的电极反应为:锌片:Zn + 2OH- - 2e- = ZnO + H2O
石墨:O2 + 2H2O + 4e- = 4OH-. 根据此判断,锌片是:( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
17.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.原子半径:甲<乙
C.甲、乙跟稀盐酸构成的原电池,氢气在乙电极放出
D.乙不能从甲的盐溶液中置换出甲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com