
27.(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子
(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
26.(10分)请根据下图作答:
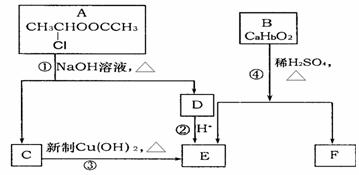
已知:一个碳原子上连有两个羟基时,易发生下列转化:
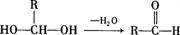
(1)E中含有的官能团是 。
(2)反应③的化学方 。
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,
则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加反应的化学方程式为 。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中一种的结构简式 。
(二)(茉莉花)是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(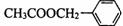 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
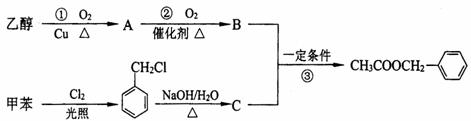
(1)C的结构简式为__________________________。
(2)写出反应①的化学方程式:_______________________________。
(3)反应③的反应类型为______________________________。
(4)反应__________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
25.(10分)(一)糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和_____________(写名称),
进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)
和____________(写结构简式或名称)。人体中共有二十多种氨基酸,其中人体自
身_______________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生 成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:_____________________。
24.(9分)下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系,请回答后面的问题:
|
pH |
c(CrO42-) |
c(HCrO4-) |
c(Cr2O72-) |
c(H2CrO4) |
|
4 |
0.0003 |
0.104 |
0.448 |
0 |
|
5 |
0.0033 |
0.103 |
0.447 |
0 |
|
6 |
0.0319 |
0.0999 |
0.437 |
0 |
|
7 |
0.2745 |
0.086 |
0.3195 |
0 |
|
8 |
0.902 |
0.0282 |
0.0347 |
0 |
|
9 |
0.996 |
0.0031 |
0.0004 |
0 |
(1)写出铬酸电离反应方程式
。
(2)若要得到CrO42-应控制的条件是 。
(3)铬酸(H2CrO4)溶液中,电离出CrO42-电离平衡常数为K2,电离出Cr2O72-电离平 衡常数为K3,则K2 K3(填>、=、<)
(4)铬酸的物质的量浓度为 。(精确到小数点后2位)
23.(15分)
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。
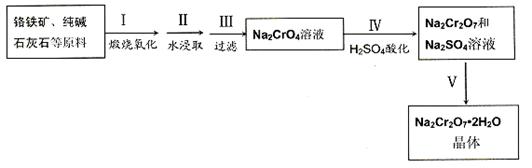
(1)步骤I的反应有:4 FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7- 8,并煮沸除去铝和硅的化合物,其离子方程式为:
(3)步骤IV反应为:2CrO42-+2H+= Cr2O72-+H2O,平衡常数表达式为:K=
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:
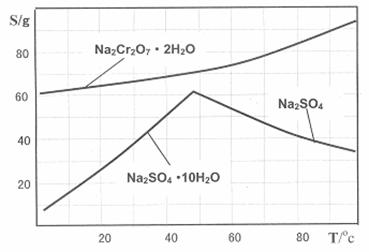
(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是 。
22.(13分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。
原因是: 。
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通
入O2的目的是(用化学反应方程式表示) 。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,
但实际操作中较少使用,原因可能是 。
21.(11分)某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
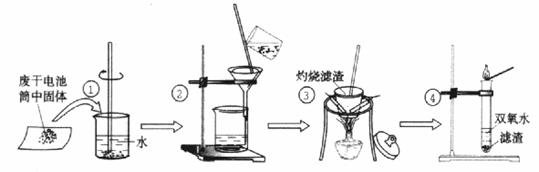
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气 体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1.检验Cl- |
取少许滤液于试管中,
|
|
含有Cl- |
|
2.检验NH4+ |
取少许滤液于试管中, |
|
含有NH4+ |
|
3.检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是:
。
通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,
可用 法。
20.(11分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反
应的化学方程式为 。
某同学未加入氧化剂,而是利用电化学知识设计了一个实验装置,也能使铜溶于稀盐酸。请在方格中画出该装置:

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?
(填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?(忽略反应前后溶液体积的变化) (填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:
。
19.(8分)试用以下仪器或装置(根据需要,可以加入固体或液体试剂)完成下列实验问题:
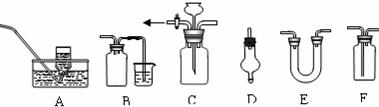
(1)可用于干燥SO2 气体的装置有 (填序号,下同)
(2) 既能用于收集Cl2 又能用于收集NO的装置有
(3)若需纯净的氯气,则用于除去Cl2 中HCl、H2O的装置有
(4)可用于控制气流使其平稳、又能起到安全瓶作用的是
(5)若用B装置使制取的SO2 与小烧杯中的NaOH反应,则其中广口瓶的作用是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com