
9.下列离子方程式错误的是 ( )
A.向偏铝酸钠溶液中滴加少量盐酸:AlO2-+H++H2O =A1(OH)3↓
B.实验室制取氯气:MnO2 +4H++2C1一=Mn2++2H2O +C12 ↑
C.向三氯化铁溶液中加入过量铜屑:2Fe3++Cu=2Fe2++Cu2+
D.用NaOH溶液吸收少量H2S 气体:OH一+H2S =HS一+H2O
8.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuS04,“安乐泉”水质偏碱性。下列有关说法可能符合题意的是 ( )
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2 OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确
7.世界上许多科学家都强烈反对发展超音速运输飞机(SST),其主要原因是 ( )
A.燃料燃烧时,尾气中的氮氧化物易发生爆炸
B.燃料燃烧时,尾气中的氮氧化物易腐蚀飞机发动机
C.燃料燃烧时,尾气中的氮氧化物会严重破环臭氧层
D.燃料燃烧时,尾气中的氮氧化物导致光化学烟雾
6.下列实验方案合理的是 ( )
A.用亚硫酸钠和硝酸反应制备二氧化硫
B.以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性:盐酸>碳酸>石炭酸
C.用稀硫酸检验生石灰里是否混有石灰石和石英
D.用饱和碳酸钠溶液除去二氧化碳中的氯化氢
25.(4分)向140mL一定浓度的硝酸溶液中加入32.0g铜粉,充分反应,铜完全溶解。产生NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)待产生的气体全部释放后,向溶液加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
(2)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要质量分数为 的双氧水50.0g。
24.(13分)有甲、乙、丙三种常见的气体单质,且式量甲>丙,在一定条件下可按下图关系转化为X、Y、Z三种化合物。
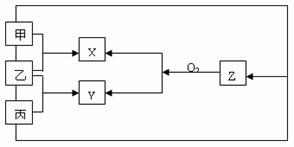
请回答下列问题:
(1)在X,Y,Z中,一定含有乙元素的是 。
(2)三种化合物的化学式:X为 ,Y为 ,Z为 。
(3)写出Z与O2反应的化学反应方程式: 。
(4)Z属于 分子(填“极性”或“非极性”),其电子式为 。
(5)组成甲单质的元素在周期表中处于 周期 族。
(6)Z的浓溶液常用于工业上液氯输送管道的检漏。其原理是 。
23.为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)
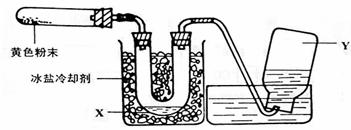
回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 ;气体Y可能是 。
(3)当导管口不再有气泡冒出时,立即停止实验,这时在操作上应注意 ,理由是 。
(4)Pb(NO3)2热分解的化学方程式 。
(5)用简单的实验证实(2)中对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
22..(8分)现有下列短周期元素性质的数据:[提示:同周期原子半径从左到右逐渐减小,同主族原子半径从上到下逐渐增大;同主族元素有相同的最高正价和最低负价。
2NO+O2 =2NO2 , 2NO2(g)
 N2O4(g);(放热)。]
N2O4(g);(放热)。]
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高正化合价 |
无 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
最低负化合价 |
–2 |
无 |
无 |
–3 |
–1 |
无 |
–3 |
试回答下列问题:
(1)上述元素中处于第IA族的有 ,处于第二周期的有 (以上均用编号表示)。
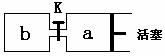
(2)如下图所示(与K相连的细管的体积忽略不计,活塞与筒壁的摩擦力不计)。在标准状况下,a中充入元素①的单质气体V L,b中充入由元素⑦和①以原子个数比1︰1形成的纯净气体V L。打开K,观察到的现是 、 ;足够长时间后,a中气体体积范围是 至 之间。此后,快速推活塞,使a中气体全部进入b中,观察到的现象是 、 。
21.(10分)在2L含16molKIO3、8molKHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应产生:
① IO3-+5I-+6H+=3I2+3H2O ② 3I2+3 HSO3-+3H2O=6 I-+3 HSO4-+6H+
当反应进行到15min时,溶液颜色突然变为蓝色,但随之又极快消失,这一反应称为时钟反应,有人用它来解释生物钟现象。
(1) 在KIO3中碘元素的化合价是 ,在反应②中还原剂是 。
(2) 在整个反应过程中,起催化作用的物质是 ,写出总的离子方程式 。
(3) 上述两个反应中,反应速率较快的是 (填序号) 。若测得5 min时KIO3有10mol,则5 min时反应①的反应速率可表示为v(KIO3)= mol·L-1·s-1。
(4)请解释溶液颜色迅速变蓝、又很快消失的原因 。
20.(4分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(固)+dD。当反应进行一定时间后,测得A减少n mol,B减少了
cC(固)+dD。当反应进行一定时间后,测得A减少n mol,B减少了 0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡。
0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡。
(1)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A 、B 、D ;
(2)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则正反应为 反应(填吸热或放热)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com