
4.有t℃的a g KCl不饱和溶液,其质量分数为ω1,采取措施后使其变为b g饱和溶液,其溶质质量分数为ω2,下列说法正确的是
A.a一定小于或等于b B..aω1一定等于b ω2
C.t℃时KCl溶解度一定大于100ω1 D.ω1一定大于ω2
3.下面几位同学自己总结出的结论中不正确的是
A.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.式量比空气(29)小的气体不使用向上排空气法收集
C.有些化学反应可以不属于化合、分解、置换、复分解中的任何一种反应类型
D.原子晶体的熔点不一定都比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
2.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
A.暖冰中水分子是直线型分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.暖冰中水分子的各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体如HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
27.(10分)元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)上述五种元素中第一电离能最小的是 ,电负性最大的是 。(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:
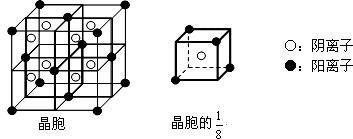
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物化学式为
26.(10分)丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如下图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N)
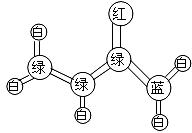
(1)丙烯酰胺的分子式为 ,结构简式为
(2)有关丙烯酰胺的说法正确的是
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酰胺的方法之一是(反应均在一定条件下进行):
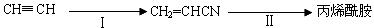
反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为
,反应Ⅱ的方程式为
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式
25.(10分)聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:

(1)乙是PVC的单体,其结构简式为
(2)反应③的化学方程式为
(3)写出以下反应类型:反应① ;反应②
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸(结构简式如下图)
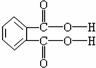
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为
24.(12分)铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
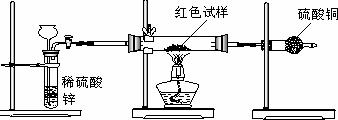
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
23.(11分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)=
Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+
+ 4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
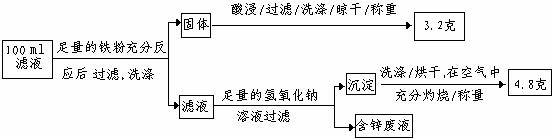
则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1
22.(10分)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:
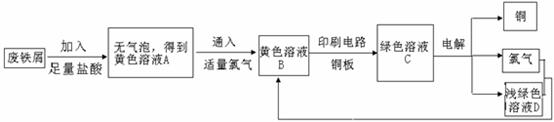
(1)写出废铁屑与盐酸反应的离子方程式: ;
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
编号 |
实验内容 |
实验操作 |
预期现象和结论 |
|
① |
检验黄色溶液A中是否含有Fe2+ |
|
|
|
② |
检验绿色溶液C中是否含有Fe3+ |
|
|
(3)电解过程中的阴极材料是
(4)采用排液法收集氯气,该液体是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com