
17.(09黔东南)某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表。
|
样品 |
第1份 |
第2份 |
第3份 |
第4份 |
|
取样品质量(g) |
50.0 |
50.0 |
50.0 |
50.0 |
|
取稀硫酸质量(g) |
40.0 |
80.0 |
120.0 |
160.0 |
|
产生气体质量(g) |
0.4 |
0.8 |
1.0 |
1.0 |
试计算:
⑴经分析,在第1份样品测得的数据中, (填物质)完全反应了。(1分)

⑵列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数。(6分)

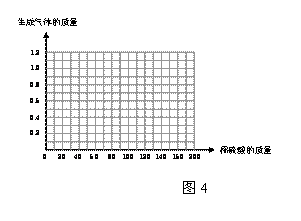 ⑶请在图4中画出在50.0g样品中加稀 酸的质量与产生气体质量变化关系的示意图。(1分)
⑶请在图4中画出在50.0g样品中加稀 酸的质量与产生气体质量变化关系的示意图。(1分) 
19、(09临沂)我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造及其、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
|
|
第一次 |
第二次 |
第三次 |
|
加入稀盐酸的体积(mL) |
5 |
5 |
5 |
|
生成氢气的质量(g) |
0.04 |
m |
0.02 |
试求:
(1) m= 。
(2)此黄铜样品中锌的质量分数是多少?
34.(09嘉兴)某同学发现金属眼镜架表面经常会有绿色物质产生,这是什么物质呢?他和同学们收集积累了一定量的这种绿色物质,放在试管里隔绝空气加热。观察到试管内壁有水珠,绿色物质变成黑色粉末,产生的气体能够使澄清石灰水变浑浊。
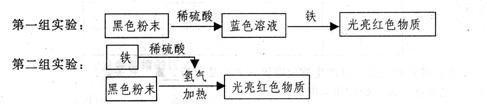 (1)实验表明:镜架上的绿色物质中一定含有 ▲ 元素。镜架上会产生绿色的锈,这绿色物质中是否含有铜呢?同学们用上述试管中的黑色粉末分两组分别进行了实验:
(1)实验表明:镜架上的绿色物质中一定含有 ▲ 元素。镜架上会产生绿色的锈,这绿色物质中是否含有铜呢?同学们用上述试管中的黑色粉末分两组分别进行了实验:
(2)大部分同学认为第一组实验方法比较理想,试简要说明理由。 ▲
26.(10分)
(1) 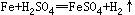 (2)2.8g
(2)2.8g
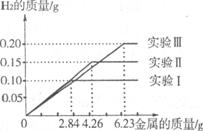
(3)由表中数据分析,实验Ⅲ中100g稀硫酸完全反应。
设实验Ⅲ生成硫酸亚铁的质量为x,消耗铁的质量为y。
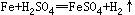
56 152 2
y x 0.2g
=,x=15.2g =,y=5.6g
所得溶液中溶质的质量分数为×100%=14.4%。
答:略。
.
26.(09潍坊)(10分)某化学调查小组的同学到钢铁厂做社会调查。他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如下图像:
 试回答(计算结果精确到0. 1%):
试回答(计算结果精确到0. 1%):
(1)写出实验中有关的化学方程式:
(2)实验I中铁参加反应的质量为 。
(3)稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少。
30.(1) Mg+H2SO4=MgSO4+H2↑ (2) Cu 5 2.5 (3) 80% (4) 20.4%
30.(09泰州)(8分)某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
|
稀硫酸用量 |
剩余固体质量 |
|
第一次加入10g |
mg |
|
第二次加入10g |
2.0g |
|
第三次加入10g |
1.5g |
|
第四次加入10g |
1.0g |
|
第五次加入10g |
0.6g |
|
第六次加入10g |
0.6g |
(1)测定过程中发生反应的化学方程式为 ▲ ;
(2)从以上数据可知,最后剩余的0.6g固体的成分是 ▲ ;这六次实验中,第 ▲ 次加入稀硫酸时样品中的镁已经完全反应;表格中,m= ▲ 。
(3)计算合金样品中镁的质量分数。
(4)计算所用稀硫酸中H2SO4的质量分数。
29.(1) B O2或氧气 H2O或水 (2) 2Cu+O2+H2O+CO2 ===Cu2(OH)2CO3
(3) [查阅资料]CO32- Cu2+ 黑 有水珠
[反思与拓展]
①将产生的气体通入足量的澄清石灰水中
②水或二氧化碳
③涂油、漆等
24.(09泰州)(6分)A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,乙是无色液体,它们之间有如下的转化关系(部分产物和反应条件未标明)。
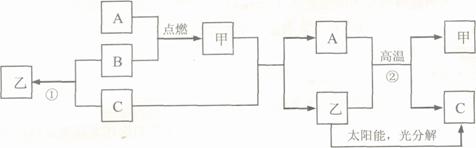
(1)推断C、甲、乙的化学式为:C ▲ ,甲 ▲ ,乙 ▲ ;
(2)写出反应②的化学方程式 ▲ ;
(3)写出反应①的化学方程式 ▲ ,该反应除了具有放出热量多,原料不受限制的优点外,还有 ▲ 的优点。
|
(3) 2H2+O2 === 2H2O 产物无污染
(09泰州)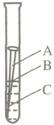 29.(11分)钢铁、铝合金、铜制品等是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
29.(11分)钢铁、铝合金、铜制品等是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
(1)如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化。
几天后,他们会发现 ▲ 处最先出现铁锈,大家结合书本知识知道,铁在空
气中生锈实际是铁和 ▲ 、 ▲ 等物质相互作用发生一系列复杂的
化学反应的过程。
(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈。他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿)。他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应。
请写出铜在空气中生成铜绿的化学方程式 ▲ 。
(3)[查阅资料]孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3·Cu(OH)2。
与孔雀石相似,还有许多矿物可用xCuCO3·yCu(OH)2(x、y都是正整数)表示,石青
就是其中的一种。
[实验探究]为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究。
|
|
实验操作 |
实验现象 |
结论 |
|
步骤l |
取少量石青样品置于大试管中加入足量稀硫酸 |
(1)产生大量气体 (2)溶液呈蓝色 |
(1)石青中含有
▲
离子 (2)石青中含有 ▲ 离子 |
|
步骤2 |
取少量石青样品置于大试管中加热 |
(1)残留固体呈 ▲ 色 (2)大试管内壁 ▲ |
石青加热易分解 |
[反思与拓展]
①确定步骤1中产生气体成分的实验方法是 ▲ 。
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和 ▲ 的质量,就可确定石青的化学式(即确定x、y的值)。
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面 ▲ (任写一种方法)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com