
30.(6分) (1)1500+375X (2)10:33 (3)52.7% (各2分)
30.(宝山二)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: _______g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: _________;
(3)若x =0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数 。
30. (1)1:3 (2分) (2)3.2(2分) (3)6048 (2分)
30.(浦东二)将质量为ag的铁和硫化亚铁的固体混合物加到300mL2mol/L盐酸中充分反应。(假设所得氢硫酸在饱和前无硫化氢气体逸出,且不考虑溶液体积变化)已知氢硫酸饱和溶液浓度为0.1mol/L,请回答:
(1)当a=1.6g,收集到氢气112mL(标准状况),则该固体混合物中,铁和硫化亚铁的物质的量之比为 。
(2)当该固体混合物a> g时,硫化氢气体开始逸出。
(3)当该固体混合物a=32g时,收集到气体的总体积为 mL(标准状况)。
写出(3)的计算过程:
30、(1)50 (2)7.62g
30. (普陀二)已知: IO3-+5I-+6H+→3I2+3H2O。工业上利用NaIO3和NaHSO3反应来制取单质I2。
①NaIO3不足时:2NaIO3+6NaHSO3→2NaI+3Na2SO4+3H2SO4
②NaIO3足量时:4NaIO3+10NaHSO3→2I2+7Na2SO4+3H2SO4+2H2O
现模拟工业制取I2。在含31.2gNaHSO3的溶液中逐滴加入2mol/LNaIO3溶液vmL。
(1)当v= mL时,再滴NaIO3就开始析出I2 。
(2)当v为55mL时,生成的I2的质量为 g。
26.(1)2AgNO3=2Ag+2NO2↑+O2↑ (2)C 无法将水排入量筒
(3)无 AgNO3分解产生的气体 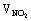 :
: 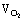 =2:1,通入水后有O2剩余。 (4) 85.0%
=2:1,通入水后有O2剩余。 (4) 85.0%
(5)F
Cu(NO3)2分解产生的气体
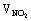 :
: 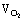 =4:1,恰好被水完全吸收,为防止液体倒吸而应选F
=4:1,恰好被水完全吸收,为防止液体倒吸而应选F
26.(卢湾一)(12分)已知AgNO3晶体加热分解生成两种单质和红棕色气体。可是用下列某些装置粗略测定混入了其它不分解也不参与反应的杂质的硝酸银纯度,并进行有关实验(装置中必要的铁架台、铁夹、酒精灯等已略去),填写下列空白。
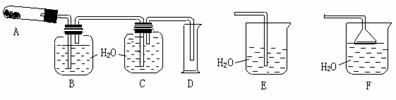
(1)写出AgNO3受热分解的化学方程式:_____________________________;
(2)测定AgNO3的纯度,可选用由A、B、C、D组成的装置,但其中不合理的是___________,该错误引起的后果是______________________________;
(3)B瓶中的空气对实验结果______(填“有”或“无”)影响,理由是_________ ;
(4)如果改进装置后,称取硝酸银试样4.00g置于A中缓缓加热,待反应完全后,产生的气体通过B、C装置后,测得量筒中水的体积,并折算成标准状况下气体的体积为112mL,则试样的纯度为_____________________;
(5)如果加热Cu(NO3)2生成氧化铜,则加热分解所得气体应通入装置________(填“E”或“F”),其理由是__________________________________。
27、(1) 把装置中的空气赶走,防止NO被氧化为NO2 ,干燥反应中生成的气体 (2) 无色气体变为红棕色 ,热 (3) 打开K1、K2持续通入一段时间的N2和O2 (2分)
(4)① 0.5 ②C中烧瓶在实验前后增加的质量 (每空2分,共4分)
(5)在A中加入过量含Cl-溶液,过滤后,将沉淀洗涤、干燥,最后称取沉淀的质量(2分)
26.(12分) (1)离子方程式: Zn+2H+→Zn2++H2↑ (2分) 。
(2)目的是 增大混合气体与催化剂的接触面积,使反应进行得更快 (2分) 。
(3)理由是从分步反应可知,产生N2的过程中,有可能直接产生氨气(1分) ,理由 将混合加热产生的气体直接通入酚酞试液,若试液变红,则说明理由成立;否则,说明理由不成立(1分) 。
下图中的 ③ 装置连接在原装置中的 A 和 B 之间。(2分)
(4)体积比为 1:3 比较适宜;原因是 无法控制通入B中N2和H2的体积比 。(2分)
(5)气体成分有 NH3、N2、H2 。(2分)
27(闸北二)、某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
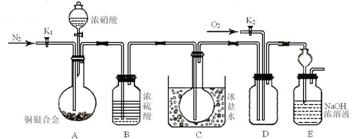
请回答下列问题
(1) 实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是
;装置中B瓶的作用是 。
(2)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是
;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(3)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol/L;实验后A中溶液:V=40mL c(H+)=1.0 mol/L。假设反应中HNO3既无挥发也无分解,则
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(5)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com