
5.(苏州)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了
进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参
与讨论并回答相关问题。
[步骤一]未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用 ▲ 溶液(填一试剂)加以检验。
[步骤二]未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是: ▲ 。
[步骤三]打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
|
实验操作 |
使用现象 |
对比结论 |
|
Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 |
现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 |
现象一与现象二对比,说明 ① ▲ |
|
现象二:粗砂纸打磨的片刻内现象不明显。 |
||
|
Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 |
现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 |
现象三与现象一对比,说明 ② ▲ |
|
现象四:特细砂纸打磨的表面一段时间内没有明显现象。 |
现象四与现象三对比,说明 ③ ▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是: ▲ 。
(5)请仔细观察下图:
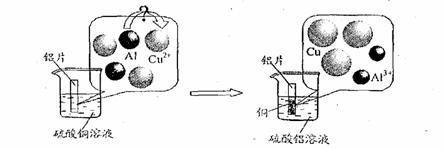
试从微观粒子变化的角度分析该反应的实质是 ▲ 。
(1)稀盐酸或稀硫酸 (2)氯离子对金属及其氧化物的结构具有较强的破坏作用(或氯离子促进反应的进行或铜盐溶液中酸根离子种类不同) (3)影响因素:①A ②B ③AC (4)证实氧化膜对反应的影响(是否破坏氧化膜) (5)在溶液中,铝比铜活泼,每2个铝原子失去6个电子,变成2个铝离子;每3个铜离子得到6个电子变成3个铜原子
4.(福州)同学们在学习碱的化学性质时,进行了如图8所示的实验。
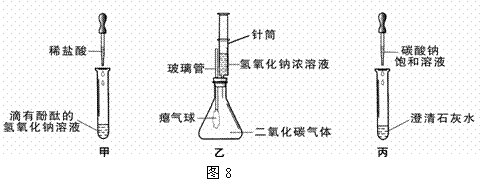

(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
[提出问题] 废液中含有哪些物质?
[交流讨论]①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠 小红认为:只有氢氧化钙 小林认为:是氢氧化钠和碳酸钠
你认为还可能是 。(写一种猜想)
[实验设计]小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
|
实验内容 |
预计现象 |
预计结论 |
|
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
的猜想正确。 |
|
②
。 |
的猜想正确。 |
|
|
③
。 |
的猜想正确。 |
[反思拓展] 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑 。
(1)NaOH+HCl===NaCl+H2O (2)气球胀大 (4)[交流讨论]① NaCl ②氢氧化钠(合理答案均可) [实验设计] ①小林 ②有白色沉淀,溶液由红色变为无色 小云 ③ 没有白色沉淀,溶液呈红色 小红 [反思拓展] 反应物是否有剩余 (合理答案均可)
3.(南京)一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。CO是从煤的气化或合成气得到的。
(1)煤的气化主要反应有:①2C+O2=2CO ②C+H2O=CO+H2 ③CO+H2O=CO2+H2
上述反应属于化合反应的是 (填序号),属于氧化反应的是 (填序号)。
(2)合成气可通过天然气的重整得到,如CH4+H2O=CO+3H2 合成气可制二甲醚,二甲醚被称为21世纪的新型燃料。合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如下:
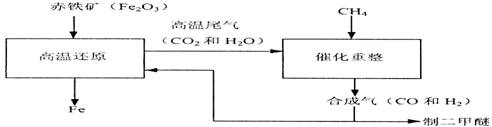
①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的。用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:
。
②合成气在冶炼铁的生产过程中所起的作用是 。
(3)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化)。
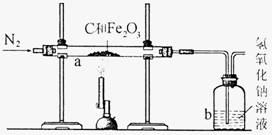
①实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?
。
③如果氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的质最变化测定出氧化铁的质量分数将 (选填“偏大”、“偏小”或“准确”),原因是 。
Ⅱ.乙同学取矿石样品10g,加入足量稀盐酸,完全反应后,共用去稀盐酸109.5g过滤得到滤渣2 g(假设杂质既不溶于水也不与酸发生反应)。请你和乙同学-起计算赤铁矿石中氧化铁的质量分数和反应后溶液中溶质的质量分数。(请写出计算过程)。

2.(烟台)小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她
设计并完成了下表所示的探究实验:
|
|
实验操作 |
实验现象 |
实验结论或总结 |
|
|
结论 |
总结 |
|||
|
实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有气泡产生,木条不复燃 |
过氧化氢分解产生氧气,但是
。 反应的化学方程式为: 。 |
二氧化锰是过氧化氢分解的催化剂 |
|
实验二 |
向盛水的试管中加入二氧化锰,伸入带火星的木条 |
没有明显现象 |
|
|
|
实验三 |
|
|
二氧化锰能加快过氧化氢的分解 |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是: ;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是: 。
(1)
|
实验一 |
|
|
反应慢
2H2O2=2H2O + O2↑ |
|
实验二 |
|
|
二氧化锰加入水中不产生氧气。 |
|
实验三 |
向盛有5mL5%过氧化氢溶液的试管中加入二氧化锰,伸入带火星的木条 |
有大量气泡产生,带火星的木条迅速复燃 |
|
(2)对比(或对照等); (3)第一方面:比较MnO2在过氧化氢分解前后的质量。 第二方面:倾倒掉反应后的液体,向剩余的固体中重新加人过氧化氢溶液,有大量气泡产生,说明MnO2仍然能加快过氧化氢的分解速率(化学性质没变)
1.(烟台)CO2是初中化学重点研究的气体之一。某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
(1)该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示。在干燥管内的铜网上应盛放 ;若将铜网换成铁网,可能产生的后果是 ,其原因是(用化学方程式表示) 。
 (2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
(2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
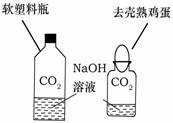
①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示。实验现象为:甲--软塑料瓶变瘪,乙--“瓶吞鸡蛋”。
小虎同学认为上述实验是可行的。其共同原理是
。
小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应。其理由是 。
小明同学针对小雯的质疑又补充了一个对照实验,这个实验是
。
②小虎向甲实验后变瘪塑料瓶的溶液中加入 ,观察到
现象,从而证明CO2与NaOH已经发生了反应。
(1)大理石(或石灰石) 铁网被腐蚀,制得的CO2气体中混有H2 Fe+2HCl=FeCl2+H2↑
(2)①氢氧化钠溶液能与CO2发生反应,瓶内气压降低 CO2能溶于水,也能使瓶内气压降低 将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别。 ②稀盐酸 有气泡产生(或加氯化钙溶液 有沉淀生成等)
39.(09兰州)(6分)2008年9月份曝光的引起国人共愤的“结石宝宝”事件,与婴幼儿服用含有三聚氰胺的奶粉有关。已知三聚氰胺为白色晶体,将它用作食品添加剂可提高食品中蛋白质的检测值,俗称“蛋白精”, 化学式为C3H6N6。据此请计算:
(1)三聚氰胺中各元素的质量比 ;
(2)三聚氰胺中氮元素的质量分数 。(写出具体的计算过程,结果精确到0.01%)
(3)某品牌合格奶粉蛋白质含量为18%,含氮量为2.88%(假设奶粉中的含氮量全部来自蛋白质)。每100g奶粉中添加0.1g三聚氰胺,理论上能增加 g蛋白质。(写出具体的计算过程,结果精确到0.01g)
30.(6分)(1)126 6∶1∶14 66.7%(每空1分)
(2)加入三聚氰胺后牛奶中氮元素的质量为
 目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象………………(1分)
目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象………………(1分)
31.(09青岛)科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON)。请你根据丙烯酰胺(C3H5ON)的化学式计算后填写:
(1)丙烯酰胺(C3H5ON)的相对分子质量为_________________;
(2)碳元素和氧元素的质量比是____________________;
(3)氢元素的质量分数为_________________。
(1)71 (2)9:4 (3)7.04%
(09烟台) 30.(6分)2008年下半年发生的毒奶粉事件,是不法分子在牛奶或奶粉中添加了有毒的三聚氰胺造成的。三聚氰胺化学式为C3H6N6,是一种重要的化工原料。
(1)三聚氰胺的相对分子质量为 ,碳、氢、氮三种元素的质量比为 ,
氮元素的质量分数为 。
(2)检测食品中蛋白质含量的传统方法是:通过检测食品中氮元素的含量,推算其蛋白质含量。例如,若检测到牛奶中的氮元素质量分数≥0.46%,即为蛋白质含量检测合格。某种不合格牛奶中氮元素的质量分数为0.36%,若向1000g该牛奶中加入2g三聚氰胺,请计算此时牛奶中氮元素的质量分数,并根据计算结果说明不法分子在牛奶中添加三聚氰胺的目的。
31.(09娄底)2009年3月以来,墨西哥、美国等国家接连发生甲型H1N1流感疫情。目前,达菲是治疗甲型H1N1流感的一种良药。达菲的化学式是C16H31N2PO8,其相对分子质量为410,请回答:
(1)该化合物中碳、氢两种元素的质量比是 68 。
(2)该化合物中氧元素的质量分数是 69 。(保留一位小数)
31题.68.192∶31(2分)69. 31.2%(2分)
20.(09娄底)元素周期表是学习和研究化学的重要工具。下表是元素周期表中的一部分,请按表中信息填空:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10Ne 氖 20.18 |
|
3 |
11Na 钠 22.99 |
12Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)查找出原子序数为10的元素名称 25 ,其相对原子质量 26 。
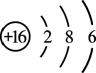
(2)硫元素的原子结构示意图为 .该元素的原子核外有 27 个
电子层,它属于 28 元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易 29 (填“得”、“失”)电子。
20题. 25 氖 26. 20.18 27 3 28. 非金属 29. 得
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com