
2.(09年广东理基·20)设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1
Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
3 .(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
.(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
题型一:以NA为桥梁,考察物质所含粒子、电子转移数目、气体摩尔体积等计算
1. (09年福建理综·8)设NA为阿伏伽德罗常数,下列叙述正确的是
(09年福建理综·8)设NA为阿伏伽德罗常数,下列叙述正确的是
 A.24g镁的原子量最外层电子数为NA B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
A.24g镁的原子量最外层电子数为NA B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
 C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
7. 某些离子或原子团是否水解,引起离子数目变化等。
[答案]本题的正确选项为A、C
在标准状况下,1mol任何气体所占体积都约为22.4L。因为决定它们体积大小的因素是气体分子间的距离,而不是分子本身体积的大小。因此对于混合气体,此结论也一定成立(混合气体在标准状况下能自发反应,而导致反应前后气体分子数不等除外如:NO和O2 )。所以在标准状况下1mol混合气体所占体积也是22.4L。反过来在标准状况下每22.4L气体所含分子数就一定是NA 。A项正确。
在标准状况下H2O 并不是气态。而对于液体或固体物质来说,决定它们体积的因素是粒子本身的大小。不同粒子,其本身大小不同,体积也就不同。在标准状况下,1mol的H2O的体积不是22.4L.B项不正确。
物质的量和质量都是与温度、压强无关的基本物理量。也就是说,1mol物质在任何温度下,所含粒子数都仍为阿伏伽德罗常数(条件是该物质在此温度下能存在且不发生反应)因此当+1价的氢被活泼金属还原成0价的氢时,只要有1molH2生成,就必然转移2mol电子,即转移电子总数为2NA(不管是标况还是常压)。C正确。
氢原子核外有7个电子,氮气分子核外有14个电子。则1molN2含有的核外电子数就是14NA. D项不正确。
6. 用到22.4L.mol-1时,必须注意气体是否处于标准状况。
5. 较复杂的氧化还原反应中,求算电子转移数目。如Na2O2和水,Cl2和NaOH溶液反应等。
4. 特殊物质的摩尔质量。例如D2O、T2O、18O2、D2等。
3. 一些物质结构中化学键的数目。例如SiO2、Si、CH4 、P4等。
2. 某些物质分子中的原子个数。例如稀有气体为单原子分子,臭氧为三原子分子,白磷为四原子分子。
例1设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA
B.在标准状况下,NA 个H2O 分子所占体积为22.4L
C.常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA
D.常温常压下,28g氮气含有的核外电子数为10 NA
[错误分析]本题易错选D项。主要原因是部分同学考虑了氮原子的核外电子排布时,只注意到最外层电子数为5而忽略了内层电子数为2,从而得出错误结论。
[解题指导]
解阿伏伽德罗常数为背景的选择题应注意的问题
1. 物质的状态 水在标准状况下不是气态;SO3 在标准状况下是固态,常温常压下是液态;在标准状况下,含碳原子数大于四而小于16的烃是液态。
4.读图,回答问题。
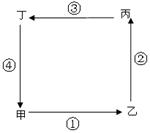
(1)若此图表示城市热岛效应,则甲地为 。为改善乙地大气质量,①处适宜布局 。
(2)若此图表示海陆间水循环,则乙处为 ,人类对图中环节影响最大的是 (填序号),改变其时空分布的有效措施是 、 。
(3)若此图为低纬度环流圈,则图中气压带形成的原因是:甲 ;乙 。
(4)若此图为太平洋大洋环流,则①洋流按成因分类属于 。
(5)若此图表示季风环流,甲为亚洲,乙为太平洋,则①的成因是什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com