
25.SO2与O2在催化剂作用下合成SO3的反应为:2SO2(g)+O2(g)  2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
 容器温度 容器温度浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
|
c(O2) |
0.8 |
0.6 |
0.3 |
0.5 |
0.7 |
|
c(SO3) |
0.4 |
0.8 |
1.4 |
1.0 |
0.6 |
(1)反应进行5min内,五个容器中平均反应速率最大的是_______________(填容器编号);
(2)计算a容器中O2的反应速率_________________;

 (3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(4)该反应是________(填“放热”、“吸热”)反应,在右图坐标中画出e容器中SO3的物质的量随时间的变化曲线。
24.H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是________;
(2)实验室可用H2O2与次氯酸钠反应制氧气, 其中还原剂是__________,写出反应的化学方程式______________,生成0.5mol氧气,转移电子_______mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
你认为其中错误的是_______(认为没有可以不填),简述理由__________________。
23.下表为元素周期表的短周期部分。请填空。
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
D |
|
E |
|
|
|
|
G |
|
|
J |
L |
|
(1)写出A原子的最外层电子的轨道表示式 ,G、J、L三种元素形成的简单离子中,离子半径最小的是__________;
(2)A元素可形成化合物Fe(AO)5,该物质常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(AO)5晶体属于 (填晶体类型);
(3)将D元素的气态氢化物通入稀硫酸中,写出反应的离子方程式_____________________;
(4)M与E同主族且核外电子比E多三个电子层,M位于元素周期表_______周期______族,有研究显示HMO具有两性,则HMO与盐酸反应化学方程式为_________________。
22.某固体粉末中可能含有KNO3、Cu(NO3)2、AgNO3三种物质中的一种或多种,取一定量该固体粉末,加热后得到A气体a L,将气体用足量水吸收,剩余气体B的体积为L。下列相关推测错误的是
A.气体B可能是O2,也可能是NO
B.固体粉末的组成为n(KNO3):n(Cu(NO3)2):n(AgNO3)=1:1:3
C.固体粉末的组成为n(KNO3):n(Cu(NO3)2):n(AgNO3)=1:1:1
D.气体A 中NO2与O2的体积比为9:1
第二卷(本卷共84分)
21.有两个容积不同的容器,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体可能具有相同的
A.分子数 B.密度 C.质量 D.颜色
20.标准状况下,将2.24LNH3通入1L 0.1mol/L的醋酸溶液中,欲确定所得溶液中NH4+、CH3COO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
A.NH3·H2O和CH3COOH的电离常数 B.NH3·H2O和CH3COONH4的电离常数
C.溶液的pH D.题给反应物的量
19.下列实验方案合理的是
A.检验混合离子溶液中的SO42-:加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成
B.除去NO中混有的少量NO2:将混合气体通入水中,再用排空气法收集NO
C.配制浓度为0.1mol/L的NaOH溶液:将0.05molNaOH溶于500mL水配成溶液
D.检验氯化铁溶液中是否混有Cu2+:纸上层析后用氨熏
18.下列离子方程式的书写正确的是
A.弱酸尼泊金酸(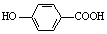 )与碳酸氢钠溶液反应
)与碳酸氢钠溶液反应
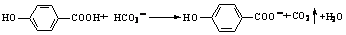
B.将0.01mol氯气通入10 mL 1 mol / L的FeBr2溶液中 2Fe2++2Br-+3Cl2 →2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液 Ca2++ HCO3- +OH- →CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全
Ba2++2OH-+H++ SO42- + NH4+ → BaSO4↓+ NH3·H2O +H2O
17.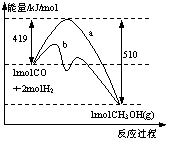 右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 510 kJ
D.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 91 kJ
16.Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。已知Co2O3在酸性溶液中易被还原成Co2+,下列反应在水溶液中不可能发生的是
A.3Cl2 + 6FeI2 →2FeCl3 + 4FeI3 B.Cl2 + FeI2 → FeCl2 + I2
C.Co2O3 + 6HCl → 2CoCl2 + Cl2↑+3H2O D.2Fe3+ + 2I- →2Fe2+ + I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com