
第一节 单项填空(共15小题,每小题1分,共15分)
从每题所给的A. B. C.D四个选项中,选出可以填入空白处的最佳选项,并在答题卷上做答。
21.All these changes will lead to ____ stronger and more Powerful China, ____ country that can help enrich the planet.
A. a ; a B. a : the C. the :a D. the : the
31.(10分)硝酸工业生产中的尾气(NO2、NO的混合气体)通常可用纯碱溶液吸收:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)在硝酸工业尾气吸收过程中,在标准状况下,每生成44.8L二氧化碳气体,可以吸收尾气 L。
(2)若工业上用21.2%的纯碱溶液吸收硝酸生产中的尾气时,若要配制10 kg该浓度的纯碱溶液,需要纯碱(Na2CO3·10H2O)质量是多少?
(3)要保证硝酸工业的尾气充分吸收,n(NO2)与n(NO)应满足何种关系?
(4)现有10 kg 21.2%的纯碱溶液,用于吸收NO2、NO,在标准状况下每产生448L二氧化碳时,纯碱溶液增重880 g。
①则生成NaNO3与NaNO2的质量比是多少?
②20℃时,10 kg 21.2%的纯碱溶液吸收完全后,蒸发掉6.88 kg水,冷却到5℃,可析出NaNO2晶体质量是多少?(已知5℃时,NaNO2 的溶解度为71.2g/100g水。忽略NaNO3的影响)。
闵行区2009学年第二学期高三年级质量调研考试
30.(6分)由于铝质蒸发器和冷凝器易氧化,影响空调的寿命。铜-铝合金蒸发器和冷凝器的成功开发解决了制冷行业的一大难题,并因此被世界制冷行业称为二十一世纪制冷行业革命性的创新。
(1)为测定该铜-铝合金的质量分数,现将5.6克该合金放入500mL 2.0mol/L的盐酸中,充分反应后得到气体6.72L(标准状况),此铜-铝合金中铝的质量分数为 。
(2)将上述反应液过滤,并将滤液稀释到1000mL,通过计算回答下列问题:
①稀释后,溶液中Al3+的物质的量浓度为 。
②取100mL溶液,要想得到0.78克沉淀,应加入0.5mol/L的氢氧化钠溶液的体积为 。
28.(10分)以下是某课题组设计的合成聚酯类高分子材料 的路线:

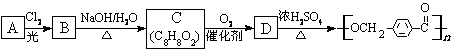
 已知:
已知: ①A的相对分子质量小于110,其中碳的质量分数约为0.9。
①A的相对分子质量小于110,其中碳的质量分数约为0.9。
 ②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: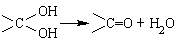
③C可发生银镜反应。
 请根据以上信息回答下列问题:
请根据以上信息回答下列问题:
 (1)A的化学式为
;A→B的反应类型是
。
(1)A的化学式为
;A→B的反应类型是
。
 (2)由B生成C的化学方程式为
;
(2)由B生成C的化学方程式为
;
该反应过程中生成的不稳定中间体的结构简式应是 。
 (3)D的结构简式为 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有______种,写出其中的一种结构简式:
。
(3)D的结构简式为 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有______种,写出其中的一种结构简式:
。
27.(12分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
________________________________________________________。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO4¯+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是 。
②计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留三位小数)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 ; 。
26.(12分)某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。
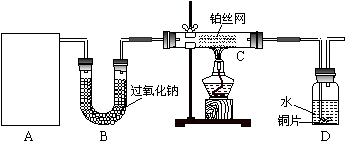
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是_______________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。
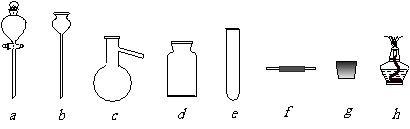
(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①______________________________________________________________________;
②______________________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用__________________________________________________________;
②写出C中发生反应的化学方程式:_________________________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_____________________。
25.(8分)已知可逆反应:Fe(s) + CO2(g) FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
|
T(K) |
938 |
1173 |
|
K |
1.47 |
2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
 ①升高温度,混合气体的平均相对分子质量_________;
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
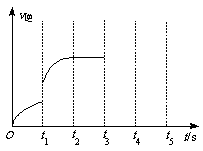
(3)该反应的逆反应速率随时间变化情况如右图所示。
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图画出t3~ t5时间段的v逆变化曲线。
③能作为判断该反应达到平衡状态的依据是 (选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com