
16.氢原子的核外电子从距核较近的轨道跃迁到距核较远的轨道的过程中
A.原子要吸收光子,电子的动能增大,原子的电势能增大,原子的能量增大
B.原子要放出光子,电子的动能减小,原子的电势能减小,原子的能量也减小
C.原子要吸收光子,电子的动能增大,原子的电势能减小,原子的能量增大
D.原子要吸收光子,电子的动能减小,原子的电势能增大,原子的能量增大
15.“黑洞”是近代引力理论所预言的宇宙中的一种特殊天体,研究认为,黑洞可能是由于超中子星发生塌缩而形成的。欧洲航天局由卫星观测发现银河系中心存在一个超大型黑洞并将它命名为:MCG6-30-15r,假设银河系中心仅此一个黑洞。已知太阳系绕银河系中心做匀速圆周运动,则根据下列哪一组数据可以估算出该黑洞的质量
A.太阳的质量和运行速度
B.太阳绕黑洞公转的周期和太阳到“MCG6-30-15r”的距离
C.太阳质量和太阳到“MCG6-30-15r”的距离
D.太阳运行速度和“MCG6-30-15r”的半径
14.下列说法中正确的是
A.物体的温度升高时,其内部每个分子的热运动动能一定都增大
B.自然界进行的涉及热现象的宏观过程都具有方向性,是不可逆的
C.当液体被压缩时,液体内分子间的引力和斥力同时增大,但斥力增大的较多
D.热量能自发地从低温物体传递给高温物体
10.(21分)某化学兴趣小组探究饱和氯水与石灰石的反应.并制墩较浓的Hcl()溶液和对所得溶液中的部分阴离子进行检验。

(I)用平衡移动的观点解释石灰石溶解氯水的原因________________________--
_________________________________________________________________.
. (2)步骤2、步骤3的实验目的都是_____________,为达到该实
越目的,还可以采取的方法是
_______________________________________________________.
(3)请仿:设计一个简单的实验方案,证明步骤l所得滤液中的HCIO浓度比饱和氯
水中Hcl0浓度大_________________________________________.
Ⅱ.摩尔盐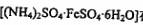 在空气中比一般亚铁盐稳定,是化学分析中常
在空气中比一般亚铁盐稳定,是化学分析中常
用的还原荆。某研究性学习小组按以下步骤制取摩尔盐: 。’
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离:
②用①处理过的铁屑和稀H2s仉反应制取FeS04:
③将③制得的FeS04:溶液与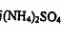 溶液混合,结晶得到摩尔盐.
溶液混合,结晶得到摩尔盐.
试回答下列问题:
如何从溶液中分解出摩尔盐______________.、
(2)如何设计-一个简单的实验证明得到的产品中有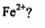 ______________________
______________________
(3)为确定产品中亚铁离子的含量,某研究小组用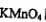 酸性溶液进行滴定,就写出该反应的离子方程式: _______________________.
酸性溶液进行滴定,就写出该反应的离子方程式: _______________________.
(4)现有等浓度的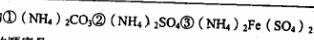 溶液.,其中
溶液.,其中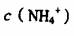 由大到小的顺序是____________ (填序号)。
由大到小的顺序是____________ (填序号)。


9.)(1 6分)加碘食盐中加人的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾起一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
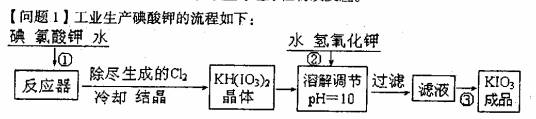
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反
应器中发生反应的化学方程式:__________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法
是_____________________________
[问题2]已知:
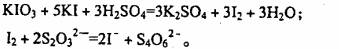
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取Wg食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液。加入过量K溶液,使K103与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10‘’mol/L的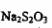 溶液
溶液
10 0mL,恰好反应完伞。则加碘食盐样品中的碘元素含量是 _______mg/g(以含
w的代数式袁示)。

①请推测实验中产生蓝色现象的可能原因,用离子方程式表示
___________________________________________________
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:--(填
“偏大”、“偏小”或“正确”)。
其原因是________________________________________________.
4]写出H和r反应生成三酯的化学方程式:-------------。
8.(14分) (Ⅰ) 食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯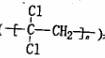 具有超强阻隔性能,可作为
具有超强阻隔性能,可作为
保鲜食品的包装材料。它是由_________(写结构简式)
发生加聚反应生成的
(2)劣质植物油中的亚油酸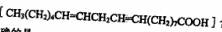 含量很低
含量很低
下列关于亚油酸说法正确的是_______(填序号)
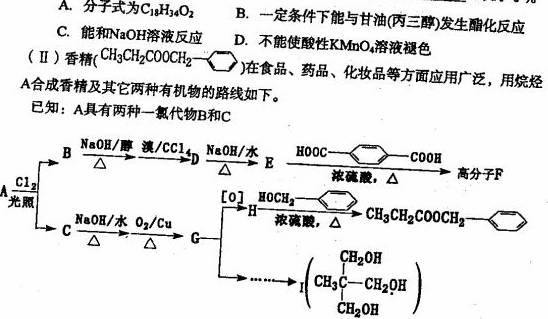
回答下列问题:
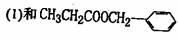 互为同分异构体的是 ______(填序号)。
互为同分异构体的是 ______(填序号)。
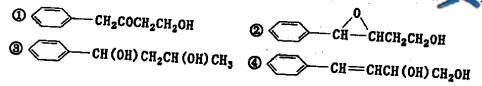
(2)D物质的名称为 ____________________-
(3)高分子F的结构简式____________________-;
(4)写出H和T生成三酯的化学方程式____________________
7.(13分)短周期元素a、b、c、d、e.f、g、h的原子序数依次增大.其中a和e、c和g、d和h同主族。b元素的最高正价和最低负价的绝对值之差为2;lmole单质能与冷水反应,在标准状况下生成11.2LH2;f原子最外层电子数等于其周期序数;h。的电子层结构与Ar原子相同。
(1)f原子结构示意图为_______;d和e形成的化合物电子式为______-;
(2)c和f简单离子的半径大小为_______;(用离子符号和‘,’、“=’’或“<.’
表示)
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案
中不可行的是 ___(填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与毗反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性
(4)下图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激
性气味的气体,B是形成酸雨的污染物之一
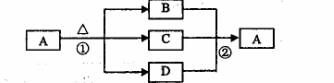 。
。
请按要求填空:
①化合物A的化学式____---。
②写出②反应的化学方程式 ____________ 。
3.阿斯巴甜具有清爽的甜味,甜味度约为蔗糖的200倍。有关说话不正确的是
A.阿斯巴甜的分子式为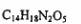
B.水解产物中有两种氨基酸
c.阿斯巴甜属于蛋白质 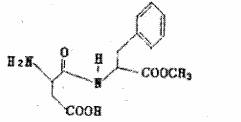
D.阿斯巴甜一定条件下既能与酸反应,又能与碱反应
4·金属加工后的废切削液中含2%一5%的NaN02,它是一种环境污染物。人们用
N'H4C1溶液来处理此废切削液,使NaN02转化为无毒物质。该反应分两步进行:
第一步:NaN02+NH4C1=NaCl+NH4N02
第二步:NH4N02=Nft+2H20
下列对第二步反应的叙述中正确的是( )。 、
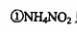 只是氧化剂
只是氧化剂 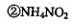 只是还原剂
只是还原剂
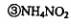 发生了分解反应 ④只有氮元素的化合价发生了变化
发生了分解反应 ④只有氮元素的化合价发生了变化
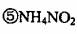 既是氧化剂又是还原剂
既是氧化剂又是还原剂
A·①③ B.①④ C.②③④D.⑤④⑤ .
5-在中学化学教材后所附的周期表中,若甲、乙、丙都是短周期元素,其中甲、
乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M
层电子数之和与L层的电子数相同。下列有关判断中正确的是( )。
A·除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其它周期均为18种元素
C.乙元素的族序数比甲元素的族序数小
D.甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙
6·一定温度下,将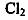 缓慢通人水中。当通人的
缓慢通人水中。当通人的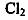 体积为
体积为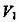 时达到饱和,溶液中
时达到饱和,溶液中
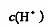 变化如下图中曲线a。已知
变化如下图中曲线a。已知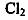 的溶解度随温度升高而迅速降低,下列叙述中正
的溶解度随温度升高而迅速降低,下列叙述中正
确的是( )。
A·将饱和氯水升温,继续通入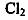 时,溶液中
时,溶液中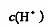 变化如曲线b
变化如曲线b
B.在饱和氯水中加入Na0H使pH>7,所得溶液中存在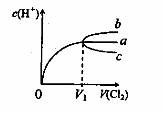
下列关系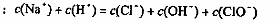
C.降温,不继续通人 时,溶液中
时,溶液中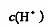 增大 。
增大 。
D·在饱和氯水中加入NaOH使 pH=7,所得溶液中存在
下列关系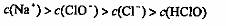
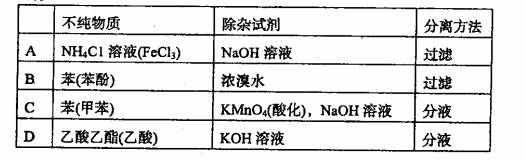
2.提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的
是( )。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com