
26.(12分)(1)CaSO4+2NH3+CO2+ H2O→CaCO3+ (NH4)2SO4(2分)
(2)CO2 (2分) NH3 (2分)
(3)b c d (2分)
(4)从CaSO4向CaCO3转化中并存着两个沉淀溶解平衡,
CaSO4(s)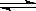 Ca2+(aq)+SO42-(aq)
Ca2+(aq)+SO42-(aq)
+
CO32-
(aq) 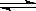 CaCO3(s) (1分)
CaCO3(s) (1分)
因为CaCO3的溶解度比CaSO4的溶解度更小,随着Na2CO3溶液的加入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,使CaSO4转化成CaCO3。(1分)
(5)17.28 (2分)
25. (16分) (1) (2分)
(2)离子键、极性共价键 (2分) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑(2分)
(3)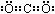 (2分) (4)O2 +
4e-+ 2H2O = 4OH- (2分)
(2分) (4)O2 +
4e-+ 2H2O = 4OH- (2分)
(5)不变 (2分) 取少量样品加入氢氧化钠溶液并加热,如产生的气体能使湿润的红色石蕊试纸变蓝,则可确定是铵根离子。 (2分)
(6)(3a – 4b) kJ/mol 或 -(4b–3a) kJ/mol (2分)
28.(16分)某有机物X是一种药物的中间体,质谱图显示相对分子质量为166。0.1 mol X完全燃烧只生成 0.9 mol CO2 与0.5 mol H2O。
(1)X的分子式是 。
(2)已知 ① 有机物X能与碳酸氢钠溶液反应生成无色无味气体;② 0.1 mol X 与2 mol/L 的NaOH溶液100 mL恰好完全反应 ③X分子中的苯环上有两个取代基。则有机物X的结构可能有 种,请写出其中任意一种同分异构体的结构简式 。
(3)X的一种同分异构体D,一定条件下能发生消去反应;其苯环上有两个邻位取代基;它有如下转化关系, 其中C的分子式为C9H9O2Cl,E是含两个六元环的酯。
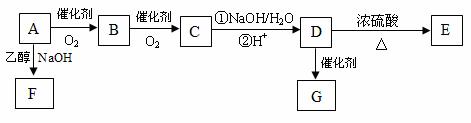
①有机物B中的含氧官能团名称为 。
②A→F的反应类型为 。
③有机物A的结构简式为 。
④由D →E的化学方程式为 。
⑤G是高分子化合物,G的结构简式为 。
答案:6.D 7.C 8.A 9.B 10.C 11. D 12. B
27.(14分)某化学小组利用下图所示的实验装置测定生铁样品(除铁和碳外,不含其它杂质)中铁的质量分数,并探究浓硫酸的性质(某些夹持仪器已略去;忽略实验前装置中的空气和实验后残留气体)。已知酸性KMnO4溶液可以把硫 从+4价氧化为 +6价。
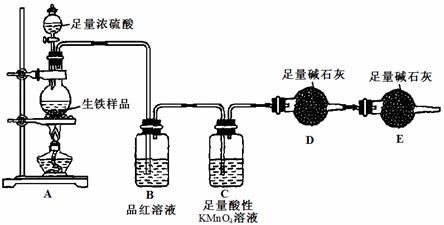
(1)开始时A中碳和浓硫酸发生反应的化学方程式为 。
(2)装置B中的现象是 ;装置E的作用是 。
(3)装置C的作用是 ;证明此结论的实验现象是 。
(4)此装置存在一定的缺陷,改进的方法是 。
(5)利用改进后的装置进行实验,若实验前称取m g生铁样品,实验结束后D管增重b g,则此样品中铁的质量分数为 (用数学式表示)。
26. (12分)某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下:
回答下列问题:
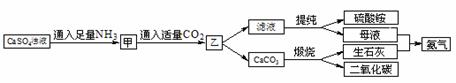
(1)利用该流程制备硫酸铵的化学方程式为________________________________。
(2)上述流程中,可以循环使用的物质是_____________、____________(写化学式)。
(3)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是____________。
a.蒸干 b.蒸发 c.冷却结晶 d.过滤
(4) 常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中加入Na2CO3溶液可得到CaCO3,请解析CaSO4向CaCO3转化的原因 。
(5)取2mol的NH3,放入容积为2.0 L的密闭容器中,反应在一定条件下达到平衡时,NH3的转化率为80%。该条件下此反应的平衡常数为 。
25.(16分)下表为元素周期表的一部分,请参照元素①-⑦表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
|
|
⑦ |
|
(1)写出③的原子结构示意图 。
 (2)⑤的最高价氧化物对应水化物所含的化学键类型是
,与⑥单质反应的离子方程式是
。
(2)⑤的最高价氧化物对应水化物所含的化学键类型是
,与⑥单质反应的离子方程式是
。
 (3)②单质在足量的④单质中充分燃烧,产物的电子式是____________。
(3)②单质在足量的④单质中充分燃烧,产物的电子式是____________。
 (4)用②单质作电极,①单质、④单质和浓KOH溶液组成原电池,其正极上的电极反应为 。
(4)用②单质作电极,①单质、④单质和浓KOH溶液组成原电池,其正极上的电极反应为 。
(5)由表中部分元素组成甲、乙、丙3种物质,其转化关系为:甲+乙→丙。已知甲、乙分子中分别含10个电子和18个电子,丙是离子化合物。向水中通入乙,恢复至原温度,则Kw (填“增大”、“减小”或“不变”) ;检验丙中阳离子的实验方法是 。
 (6)已知:②、⑥的单质各1
mol完全燃烧,分别放出热量a kJ和b kJ;
(6)已知:②、⑥的单质各1
mol完全燃烧,分别放出热量a kJ和b kJ;
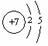
⑥单质能和②的最高价氧化物发生置换反应。
在298K时,若生成3
mol ②的单质,则该置换反应的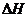 =
。
=
。
12. 下列说法正确的是
A.pH=7的CH3COOH 和CH3COONa混合溶液中,c(CH3COO-)> c(Na+)
B.0.1 mol/L的CH3COONa溶液中:c(CH3COO-)+ c(CH3COOH) = 0.1mol / L
C.将pH = 4的醋酸溶液稀释,溶液中阴、阳离子的物质的量浓度均降低
D.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
顺义区高三年级模拟考试(二)
理科综合试卷
2010年4月
第Ⅱ卷 (非选择题)
11. T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图(I)所示。保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示。下列结论正确的是
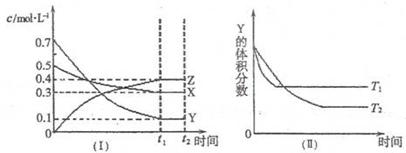
A. 图(Ⅱ)中T1>T2,则正反应是吸热反应
B.t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z。保持其他条件不变,达到平衡时z的浓度为0.4 mol/L
10. 下列实验不能达到目的的是
A.向碘水中加入四氯化碳,萃取碘水中的碘
B.向酸性KMnO4溶液中通入乙烯,验证乙烯的还原性
C.向淀粉水解后的溶液中,加入新制Cu(OH)2共热,探究水解产物的还原性
D. 向H2O2溶液中滴加少量FeCl3溶液,探究催化剂对化学反应速率的影响
9.在下列溶液中,一定能够大量共存的离子组是
A.无色溶液:Fe2+ 、SO42-、NO3-、Na+
B.pH=1的溶液:Ca2+ 、Na+ 、Mg2+ 、NO3-
C.使石蕊显红色的溶液:Fe3+ 、NH4+ 、C1-、SCN-
D.水电离出的c(H+ )=l0-14 mo1/L的溶液:ClO-、Cl-、Na+ 、Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com