
2.(海淀·文科·题2)
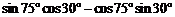 的值为( )
的值为( )
A.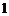 B.
B.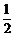 C.
C.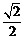 D.
D.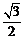
[解析] C;
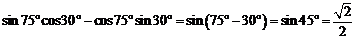 .
.
1.(海淀·理科·题3)
在四边形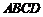 中,
中,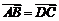 ,且
,且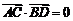 ,则四边形
,则四边形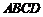 ( )
( )
A.矩形 B.菱形 C.直角梯形 D.等腰梯形
[解析] B;
∵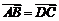 即一组对边平行且相等,
即一组对边平行且相等,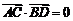 即对角线互相垂直;
即对角线互相垂直;
∴该四边形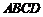 为菱形.
为菱形.
6. (山东省济南市历城区2010届高三上学期期中考试)甲烷蒸汽反应为
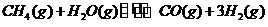 ,工业上可利用此反应
,工业上可利用此反应
生产合成氨原料气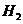 。
。
已知温度、压强和水碳比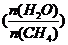 对甲烷蒸汽转化反应的影响如下图
对甲烷蒸汽转化反应的影响如下图
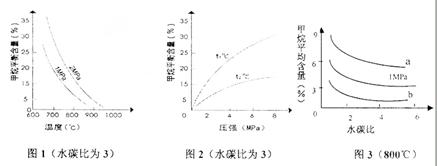
(1)该反应平衡常数K表达式为 。
(2)升高温度,平衡常数K (选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K 。
(3)图2中,两条曲线表示温度的关系是: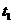
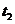 (选填“>”“=”或“< ”),
(选填“>”“=”或“< ”),
在图3中,当压强为2MPa时,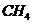 平衡含量与水碳比之间关系曲线应该是(选
平衡含量与水碳比之间关系曲线应该是(选
填“a”或“b”) 。
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10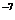 %,其目的是
%,其目的是
。
答案 (1)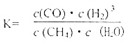 (2)增大
不变
(2)增大
不变
(3) < a (4) 防止催化剂中毒,市区活性作用
5. (湖南省四市九校2010届高三第一次联考)控制、治理氮氧化物对大气的污染是改善大气质量的重要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为 。
 (2)在一密闭容器中发生反应2NO2
2NO+O2,反应过程中NO2的浓
(2)在一密闭容器中发生反应2NO2
2NO+O2,反应过程中NO2的浓
度随时间变化的情况如下图所示。请回答:
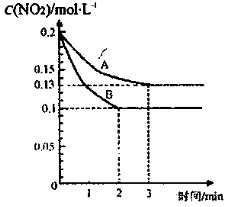 ① 依曲线A,反应在前3 min内氧气的平均反应速率
① 依曲线A,反应在前3 min内氧气的平均反应速率
为 。
② 若曲线A、B分别表示的是该反应在某不同条件下的反应情
况,则此条件是
(填“浓度”、“压强”、“温度”或“催化剂”)。
③ 曲线A、B分别对应的反应平衡常数的大小关系是
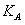
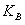 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
(3)一定温度下,容密闭容器中N2O5可发生下列反应
2N2O5(g) 4NO2(g)+O2(g) Ⅰ
4NO2(g)+O2(g) Ⅰ
2NO2(g) 2NO(g)+O2(g) Ⅱ
2NO(g)+O2(g) Ⅱ
则反应Ⅰ的平衡常数表达式为
。若达平衡时,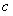 (NO2)= 0.4 mol·L
(NO2)= 0.4 mol·L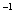 ,
,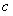 (O2)=1.3 mol·L
(O2)=1.3 mol·L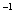 ,则反应Ⅱ中NO2的转化率为 ,N2O5(g)的起始浓度应不低于 mo1·L
,则反应Ⅱ中NO2的转化率为 ,N2O5(g)的起始浓度应不低于 mo1·L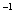 。
。
答案(1)CH4 + 2 NO2 = N2 + CO2 + 2 H2O(2分)
(2)① 0.0117 mol/(L·min)(2分) ② 温度(2分) ③ <(2分)
(3)化学平衡常数表达式略(2分) 80%(2分) 1(2分)
29.6t m(H2)×80%
则m(H2)=1.0 t
反应②、③中共需CO14 t、H22.0 t。
C + H2O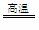 CO + H2 CH4
+ H2O
CO + H2 CH4
+ H2O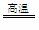 CO + 3H2
CO + 3H2
12 28 2 16 28 6
m(C) m(CH4)
得方程组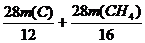 =14 t 和
=14 t 和 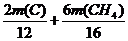 =2.0 t
=2.0 t
解得m(C)=3.0 t m(CH4)=4.0 t
所以需要焦炭3.0 t、甲烷4.0 t (6分)
11.2t m(CO)×80% m(H2)×80% m(HOCH2CH2CHO)
则m(CO)=14 t m(H2)=1.0 t m(HOCH2CH2CHO) =29.6 t
反应③中 HOCH2CH2CHO - H2
74 2
4. (江苏省丹阳高级中学2010届高三上学期期中考试)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K= 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
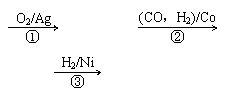 CH2=CH2
CH2=CH2
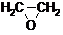
 HOCH2CH2CHO
HOCH2CH2CHO HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O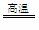 CO+H2
CH4+H2O
CO+H2
CH4+H2O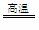 CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?要有计算过程)
答案(1)CH4(g)+H2O(g)=CO(g)+3H2(g); △H =+206.1 kJ·mol-1(2分)
(2)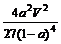 (2分)
(2分)
(3)反应②中 C2H4 ~ CO ~ H2 ~ HOCH2CH2CHO
28 28 2 74
3. (福建省福州三中2010届高三上学期期中考试)乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式 。
(2)鉴别甲烷和乙烯的试剂是 (填序号)。
A.稀硫酸 B.溴水 C.水 D.酸性高锰酸钾溶液
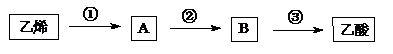 (3)若以乙烯为主要原料合成乙酸,其合成路线如下图所示(其中A与二甲醚是同分异构体)
(3)若以乙烯为主要原料合成乙酸,其合成路线如下图所示(其中A与二甲醚是同分异构体)
反应②的化学方程式为 。
答案(1)H2C=CH2 ,(2)B、D
(3)2CH3CH2OH + O2  2CH3CHO + 2H2O
2CH3CHO + 2H2O
2. (山西省四校2010届高三12月联考)生态溶液涉及农家肥的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有炽热的黑色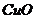 粉末的硬质玻璃管,发生的反应为:
粉末的硬质玻璃管,发生的反应为: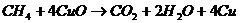 。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。(写解题过程)
。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。(写解题过程)
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为 。
答案 0.075mol 5.56%
1. (湖北省黄冈中学2010届高三10月月考)烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。
(1)烯烃的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应。请写出在催化剂作用下,两个丙烯分子间发生复分解反应的化学方程式 。
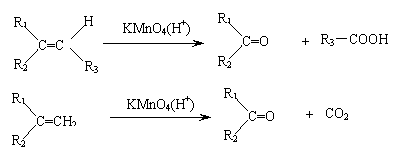 (2)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
(2)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
已知某烯烃的化学式为C5 H10 ,它与酸性高锰酸钾溶液反应后得到的产物若为乙酸和丙酸,则此烯烃的结构简式是 ;若为二氧化碳和丁酮( ),则此烯烃的结构简式是 。
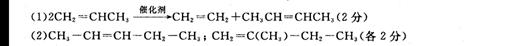 答案
答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com