
8.某能使石蕊试液变红的溶液中,能大量存在的离子是
A.Al3+ NH4+ SO42- CI- B.Na+ Mg2+ HCO3- NO3-
C.K+ Na+ AlO2- Cl- D.Fe2+ K+ NO3- Cl-
7.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A. Fe3+、CI-、Na+、SO42- B. AI3+、Na+、CO32-、NO3-
C. Ag+、Na+、SO42-、NO3- D. AIO2-、CO32-、K+、Na+
6.某溶液由水电离出的c(H+)=10-12mol/L,则此溶液中可能大量共存的离子组是
A.HCO3-、Cl-、NH4+、Mg2+ B.Na+、K+、NO3-、Cl-
C.K+、Ba2+、I-、NO3- D.Ba2+、Na+、Cl-、SO42-
5.在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是
A.Na+、Cu2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D.K+、S2-、SO42-、OH-
4.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸,对于下列物质不能确认其在溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
3.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO-3 Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
2.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
1.下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、Cl-、 S2- B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32- D.SO32-、NO3-、SO42-、HCO3-
(四)、能水解的阳离子与能水解的阴离子一般不能同时存在在同一溶液中,即离子间能发生“双水解”反应。例如:Al3+和HCO3-,Al3+和CO32-,Al3+和S2-,Al3+和HS-,Al3+和AlO2-,Al3+和C6H5O-,Fe3+和AlO2-,Fe3+和HCO3-,Fe3+和CO32-,NH4+和AlO2-等。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。特别注意:NH4+和CO32-、NH4+和HCO3-、NH4+和CH3COO-在同一溶液中能大量共存。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液、由水电离出的H+或OH-浓度为1×10-10mol/L的溶液等。
②有色离子:MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+使溶液呈现一定的颜色。
③MnO4-、NO3-、Cr2O72-等在酸性条件下具有强氧化性。
④注意题目要求“一定大量共存”、“可能大量共存”还是“不能大量共存” 等要求。
3.审题时还应特别注意以下几点:
(1)注意溶液的酸碱性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下发生3Fe2++NO3-+4H+=3Fe3+ + NO↑+2H2O而不能大量共存;I-与NO3-能共存,但在强酸性条件下不能大量共存;MnO4- 与Cl-在强酸性条件下也不能大量共存;S2-与SO32-在碱性条件下可共存,但在酸性条件下不能大量共存。
(2) 弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-)既不能与H+大量共存也不能与OH-大量共存。如:HCO3-+OH-=CO32-+H2O (HCO3-遇碱时进一步电离)
HCO3-+H+=CO2↑+H2O。
(3) 注意挖掘题目中隐含的信息,排除干扰信息,克服非智力因素失分。
离子方程式的书写正误是历年高考必出的试题,考查离子方程式的目的主要是了解考生使用化学用语的准确程度和熟练程度,具有一定的综合性。从命题的内容看,存在着三种特点:
⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等。
(2)所涉及的化学反应类型以复分解反应、溶液中的氧化还原反应为主。
⑶一些重要的离子反应方程式,在历年考卷中多次重复。
4. 离子方程式正误判断规律(八“看”)
⑴看离子反应是否符合客观事实,不可主观臆造产物及反应。
⑵看“=”“≒”“↑”“↓”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3-不能写成CO32-+H+
⑷看是否漏掉离子反应。
⑸看电荷是否守衡。
⑹看反应物或产物的配比是否正确。
⑺看是否符合题设条件及要求。
⑻看物料是否守衡。
3. 例题精讲
[例1]下列各组中的离子,能在溶液中大量共存的是:
A.K+、Ag+、NO3-、Cl- B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3- D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl- F.K+、H+、NH4+、OH-
解析:A组中:Ag++Cl-=AgCl↓ B组中,Ba2++CO32-=BaCO3↓
C组中,Mg2++2OH-=Mg(OH)2↓ D组中,2H++CO32-=CO2↑+H2O
E组中,各种离子能在溶液中大量共存。
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。
NH4++OH-=NH3·H2O或NH4++OH-=NH3↑+H2O
答案:E
[例2]在pH=1的无色透明溶液中,不能大量共存的离子组是:
A.Al3+、Ag+、NO3-、I- B.Mg2+、NH4+、NO3-、Cl-
C.NH4+、K+、S2-、Br- D.Zn2+、Na+、NO3-、SO42-
解析:题目给出两个重要条件:pH=1(即酸性)和无色透明,并要求找出不能大量共存的离子组。选项A中Ag+与I-不能共存,生成黄色的AgI不溶于HNO3(H+和NO3-),Al3+、NO3-、H+都为无色,符合题意。选项B、D中的各离子虽都是无色的,但能共存于酸性溶液中,不符合题意。选项C中各离子能够共存,且为无色,但S2-与H+不能大量共存,所以C也符合题意。 答案:A、C
[例3]下列各组离子,在强碱性溶液中可以大量共存的是:
A.K+、Na+、HSO3-、Cl- B.Na+、Ba2+、AlO2-、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、ClO-、S2-
解析:A中HSO3-+OH-=SO32-+H2O C中NH4++OH-=NH3·H2O
D中ClO-具有强氧化性,S2-具有还原性,发生氧化还原反应 答案:B
[例4]下列各组离子在水溶液中能大量共存的是:
(1)I-、ClO-、NO3-、H+ (2)K+、NH4+、HCO3-、OH-
(3)SO32-、SO42- 、Cl-、OH- (4)Fe3+、Cu2+、SO42- 、Cl-
(5)H+、K+、AlO2-、HSO3- (6)Ca2+、Na+、SO42- 、CO32-
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
解析:通常组合选择题需对题干及各项逐一分析,选出符合题意的组合,然后与各选项比较得出结论。但本题可用排除法,先判断出组合(1)由于次氯酸是弱酸,故ClO-与H+不能大量共存,发生反应:H++ClO-=HClO,次氯酸有较强的氧化性以及硝酸(NO3-、H+)都能与I-(具有还原性)发生氧化还原反应,因此该组不合题意,凡是含(1)的选项即A和D都不正确,可以排除。(2)中因发生:NH4++OH-=NH3·H2O,HCO3-+OH-=CO32-+H2O而不能大量共存,由此排除C,正确答案为B。其中(3)和(4)这两组离子在水溶液中能大量共存。本题涉及的组合(5)也不能大量共存,因为发生:H++AlO2-+H2O=Al(OH)3↓,H++HSO3-=SO2↑+H2O而不能大量共存。组合(6)中因Ca2++CO32-=CaCO3↓析出沉淀而不能大量共存。 答案:B
[例5]下列各组离子,能够在溶液中大量共存的是:
A.Na+、Al3+、NO3-、AlO2- B.Na+、Ca2+、HCO3-、HSO4-
C.Cu2+、K+、NO3-、OH- D.S2O32-、Na+、H+、SO42-
E.Fe3+、Cl-、SCN-、K+ F.Fe3+、NH4+、Cl-、NO3-
G.Fe2+、Cl-、NO3-、H+ H.Na+、Al3+、SO42-、HCO3-
解析:解本题的关键在于熟悉离子反应、盐类水解、氧化还原反应的规律以及某些特殊离子的存在条件是否由于其它离子的存在而遭破坏。下列各组离子,因为发生下列反应不能大量共存。
A组:Al3++3AlO2-+6H2O=4Al(OH)3↓ B组:HCO3-+HSO4-=H2O+CO2↑+SO42-
C组:Cu2++2OH-=Cu(OH)2↓ D组:S2O32-+2H+=SO2↑+S↓+H2O
E组:Fe3++3SCN-=Fe(SCN)3 G组:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
H组:Al3++3HCO3-=Al(OH)3↓+3CO2↑ F组:能大量共存 答案:F
[例6]下列离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O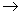 2C6H5OH+ CO32-;
2C6H5OH+ CO32-;
C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-;
D.Mg(HCO3)2溶液中加入足量NaOH溶液: Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O.
解析:B中不论CO2多少,均得HCO3-;C中应先氧化Fe2+。 答案:A、D
[例7]下列离子方程式正确的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2O
C.将1-2mL氯化铁饱和溶液加入到20 mL沸水中:
Fe3++3H2O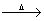 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O
解析:A应为H++SO42-+Ba2++OH-=BaSO4↓+H2O; D中氢碘酸有还原性,要还原
+3价的铁:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
答案:B、C
[例8]下列离子方程式正确的是
A.等物质的量浓度的Ba(OH)2溶液与明矾溶液以体积比3比2混合
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O
C.H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入Na2S溶液 Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
解析:B中硝酸有氧化性,要氧化+2价的铁:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O;
C应为2H218O+2 Na2O2=2 Na OH+2 Na 18OH+O2↑;D应为Cu2++S2-=Cu S↓ 答案:A
[例9]下列离子方程式的书写正确的是
A.FeS固体与稀HNO3溶液混合 FeS+2H+=2Fe2++H2S↑
B.NH4HSO4溶液中加入足量Ba(OH)2溶液 H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.Ca(ClO)2溶液中通入足量的CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
D.等浓度等体积的Ca(H2PO4)2溶液与NaOH溶液混合 Ca2++H2PO4-+OH-=CaHPO4↓+H2O
解析:A中硝酸有氧化性,要氧化+2价的铁和-2价的硫;
B应为NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O; C中CO2足量应生成HCO3-。
答案:D
[例10]下列离子方程式书写正确的是
A.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
B.向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.向Ca(HCO3)2溶液中滴入过量的NaOH溶液 Ca2++2 HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.112mL(S.T.P)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
解析:A中SO32-要被HClO 氧化;D中Cl2少仅氧化Fe2+ 答案:B、C
4.实战演练
(三)、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如Fe3+和SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应的发生而不能大量共存。
[Fe(SCN)]2+等络合反应的发生而不能大量共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com