
15、某反应过程中体系的能量变化如图所示,下列说法错误的是 ( )
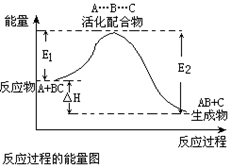 A.反应过程可表示为:A+BC-→[A…B…C] -→AB+C
A.反应过程可表示为:A+BC-→[A…B…C] -→AB+C
(反应物)(过渡态) (产物)
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D.此图中逆反应的热效应△H=E1-E2,为吸热反应
14.下列离子方程式正确的是 ( )
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B. FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
C. AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
13. 已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是 ( )
A.10mL B.5mL C.大于5mL D.小于5mL
12、一定温度下,向BaSO4悬浊液中加水,下列叙述正确的是 ( )
A、BaSO4的溶解度、Ksp均不变 B、BaSO4的溶解度增大,Ksp不变
C、BaSO4的溶解度不变,Ksp增大 D、BaSO4的溶解度、Ksp均增大
11.下列叙述正确的是 ( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液加水稀释10倍后pH=4
C.0.2 mol/L的盐酸与等体积水混合后,溶液的pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后溶液的pH=7
10. 将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是( )
A. KCl B. Mg(OH)2 C. Na2CO3 D. MgSO4
8、在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
A.NH4++2H2O
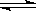 NH3·H2O+H3O+ B.HCO3-+ H2O
NH3·H2O+H3O+ B.HCO3-+ H2O 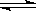 H3O+ + CO32-
H3O+ + CO32-
C.HS-+H+=H2S
D.Cl2+H2O 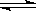 H++Cl-+HClO
H++Cl-+HClO
9 下列关于弱电解质的说法正确的是: ( )
A. 弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断。
B. 同一弱电解质,浓度越大,电离度越大。
C. 升高温度,弱电解质的电离程度减小。
D. 电解质越弱,则其的溶液导电能力就越差
7.下列各组离子一定能大量共存的是 ( )
A.含有大量Fe3+的溶液中:NH4+、Na+、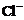 、
、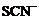
B.在强碱溶液中:Na+、K+、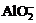 、
、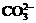 -
-
C.在c(H+)= 10-13mo1/L的溶液中:NH4+、A13+、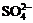 、
、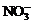
D.在pH=1的溶液中:K+、Fe2+、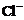 、
、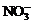
6.本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
5.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 ( )
A.加热 B.加压 C.减少生成物浓度 D.加大反应物浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com