
25. (10分)氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl + 2H2O Cl2 ↑+
H2 ↑+ 2NaOH
(10分)氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl + 2H2O Cl2 ↑+
H2 ↑+ 2NaOH
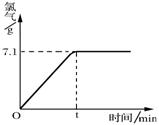 现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电。生成氯气的质量与时间的关系如右图所示。
现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电。生成氯气的质量与时间的关系如右图所示。
请计算:
⑴参加反应的氯化钠是多少克?生成氢气多少克?
⑵反应后所得溶液中溶质的质量分数是多少?
(精确到0.1%)
2010年金平区初中毕业生学业模拟考试
24.(6分)美国“9.11”恐怖事件给纽约市带来了一场严重的环境灾难--“石棉污染”,世贸大厦中的装修材料石棉纤维若被人体吸入易患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2Mg5SixO22(OH)2。请计算回答:
(1)该石棉是由 种元素组成的。 (2)钙元素和镁元素质量比是 。
(3)硅的化合价为+4价,则这种石棉的化学式中的x= 。
23.(18分)呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂。为了探究其反应原理,兴趣小组同学在老师的指导下,进行了如下探究,请你一起参与。
[查阅资料]过氧化钠在常温下与水或二氧化碳反应都放出氧气,并分别生成氢氧化钠、碳酸钠。
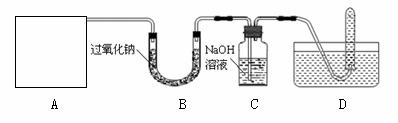
[设计实验]浩明同学想通过下图装置探究过氧化钠与二氧化碳的反应,并验证反应产物。
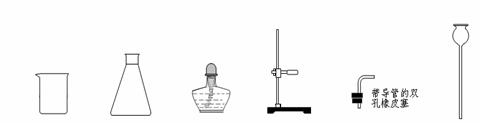 (1)下列是实验室常用的仪器:
(1)下列是实验室常用的仪器:
①A是二氧化碳气体的发生装置,装配该装置时,应选用的仪器除带导管的双孔橡皮塞外,还需要的仪器有(填名称) 、 。实验室制取二氧化碳的化学方程式 。该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式 。
②实验室选择制取气体的发生装置,主要依据是 、 。
(2)用D所示的方法收集氧气,其依据是 。
(3)C中氢氧化钠的作用是吸收没有参与反应的CO2,如果没有连接这个装置,可能导致的后果是 。
(4)检验B中反应后剩余固体的成分。
|
实验步骤 |
实验现象 |
实验结论及方程式 |
|
①取少量B中反应后的固体于试管中; ② ; ③ 。 |
② ③ |
反应后生成的固体是碳酸钠。
|
[反思与评价](1)通过上述实验,浩明同学认为Na2O2与CO2反应除了生成Na2CO3和O2,
还有可能生成NaHCO3。你认为他的结论 (选填“正确”或“不正确”)。
写出Na2O2与二氧化碳反应的化学方程式 。
(2)请说说呼吸面具或潜水艇用过氧化钠作为供氧剂的最大优点 。
22.(10分)现有下列仪器或装置,请回答下列问题:
|
(2)草酸(H2C2O4) 固体在浓硫酸作用下发生反应: H2C2O4======CO2↑+CO↑+H2O,若用该反应来制取CO,制气装置应选 (填字母);除去其中的CO2可选仪器AC,C中装入的试剂最好是 (填小写字母): a. 烧碱溶液 b. 浓硫酸 c. 澄清石灰水
 (3)若用CO还原氧化铜粉末,应选装置 (填字母),其反应方程式为
。
(3)若用CO还原氧化铜粉末,应选装置 (填字母),其反应方程式为
。
(4)右图为某种“微型”实验装置。如果G处装稀盐酸,H处
放少量铁屑,则加热处的现象为 ;
“微型塑料滴管”相当于上图实验装置中的 (填字
母);用微型仪器进行实验,除试剂用量极少以外,还可
能具有的优点是 (写1点)。
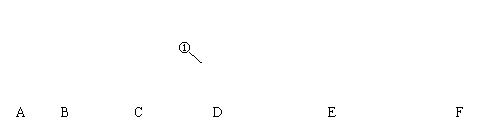
21.(9分)某研究性学习小组的同学欲分离氯化钠和氯化钙的混合物,设计了如下实验操作:
(1)X是 (写化学式)。判断X过量的方法是
(2)④和⑤操作的名称是 。
(3)小组内的乙同学认为,上述所得的NaCl固体不纯,要得到较纯净的NaCl固体,需对实验进行改进,他的做法是 。
(4)小组内同学想进一步探究混合物中氯化钠的质量分数。丙、丁两位同学提出了两个方案:
 丙同学
丁同学
丙同学
丁同学
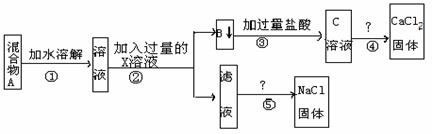
20.(7分)A、B、C、D为中学化学中常见的物质,其中A为含三种元素的钠盐,其水溶液pH大于7.B可用作固体干燥剂。D是相对分子质量为100的白色不溶物。它们的相互关系如下图所示:
请填写下列空白:
(1) A B D (填写化学式);
(2) D转化为B的反应类型为 (填基本反应类型);
(3) E中一定含有的溶质是 ,理由是 (用
化学方程式表示)
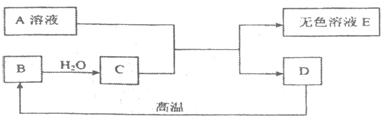
17.(6分)A元素的原子结构示意图为: A元素在化学反应中容易
 _____电子,属_________元素(填金属或非金属);B元素的离子结构示意图为:
,该离子带______个单位正电荷,该元素的原子核外总共有_______个电子。A、B元素形成化合物的化学式(用A、B表示)为_____________。
_____电子,属_________元素(填金属或非金属);B元素的离子结构示意图为:
,该离子带______个单位正电荷,该元素的原子核外总共有_______个电子。A、B元素形成化合物的化学式(用A、B表示)为_____________。
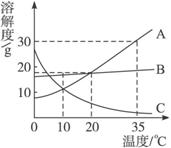 18.(4分)A、B、C三种固体物质的溶解度曲线如图所示。
18.(4分)A、B、C三种固体物质的溶解度曲线如图所示。
据图完成下列问题:
(1)升高温度,接近饱和的 ______ 物质溶液会变得饱和。
(2)10 ℃时,三种物质溶解度大小关系为:__________。
(3)35 ℃时,A物质的饱和溶液中:溶质、溶剂、溶液
的质量比为____________。
(4) 要将A从它的饱和溶液中结晶出来,最好采取
____________的方法。
19.(6分)实验室中,用98%的浓硫酸稀释成200g 20%的稀硫酸。下表是硫酸溶液的密度与溶质的质量分数对照表(20℃),请回答下列有关问题:
|
密度(g/cm3) |
1.14 |
1.30 |
1.50 |
1.73 |
1.84 |
|
溶质的质量分数[ |
20% |
40% |
60% |
80% |
98% |
⑴实验仪器有胶头滴管、量筒、细口瓶、玻璃棒和____________。
 ⑵实验的主要步骤有计算、____________、溶解配制、装瓶并贴
⑵实验的主要步骤有计算、____________、溶解配制、装瓶并贴
标签。请填写右侧的标签。
⑶为了实验的安全,溶解时应将_________沿容器壁慢慢倒入
_______ 中,并用玻璃棒不断搅拌。
15.(4分)化学就在我们身边,它与我们的生活息息相关。请从A.石灰石、 B.纯碱、C.天然气、D.硝酸钾、E.烧碱、F. 熟石灰、G.盐酸、H.干冰 这八种物质中,选择适当的字母序号填空。
(1)可用于致冷剂是 ;
(2)改良酸性土壤的是 ;
(3)侯氏联合制碱法中的“碱”是 ;
(4)可用于肥皂、石油等工业,在生活中可用来除油污的是 。
|
⑴“Co”表示 元素(填名称),其原子的相对原子质量是 ;
⑵一氧化碳是由 两种元素组成的 (填“单质”
 或“化合物”)。
或“化合物”)。
14.下列图像能正确反映所对应叙述关系的是
图A表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
图B表示t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入量的关系
图C表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
图D表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系
 A
B
C
D
A
B
C
D
13.下列除杂质的方法不正确的是
|
选项 |
物质(括号内为杂质) |
除杂方法 |
|
A |
N2(O2) |
通过灼热的铜网 |
|
B |
KCl(MnO2) |
溶解、过滤、蒸发结晶 |
|
C |
CO2(水蒸气) |
通过盛浓硫酸的洗气瓶 |
|
D |
CaO(CaCO3) |
加入适量的稀盐酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com