
31、(山东省潍坊市2010届高三教学质量抽样检测C,16)在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39mol4·L-4;Ksp[Cr(OH)3]=7.0×10-31mol4·L-4
Ksp[Zn(OH)2]=1.0×10-17mol3·L-3;Ksp[Mg(OH)2]=1.8×10-11mol3·L-3
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小 ( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
30、(安徽省合肥市2010年高三第一次教学质量检测,16
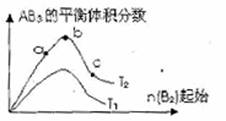 )某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
A.达到平衡时A2的转化率大小为:b>a
B.a、b、c三点的平衡常数相同
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之
比一定是1:1
高频考点十 溶液中的离子平衡问题
29、(福建省上杭一中、武平一中、长汀一中2010届高三上学期期末联考,15)用于净化汽车尾气的反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A. 装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B. 提高尾气净化效率的常用方法是升高温度
C. 提高尾气净化效率的最佳途径是研制高效催化剂
D. 570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
28、(2010届无锡市普通高中高三质量调研,11)在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g) 2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
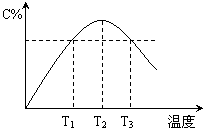 A.此反应的正反应是吸热反应
A.此反应的正反应是吸热反应
B.反应在T2温度时达到平衡
C.T3温度时正反应速率大于逆反应速率
D.T3温度时正反应速率大于T1温度时正反应速率
27、(福建省永春一中、培元中学、季延中学、石光华侨联中2010届高三上学期期末联考,12)著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈的冶炼步骤为:用稀土串级萃取法对矿石进行筛选富集;电解熔融CeO2。
B.CeO2溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素 、
、 、
、 、
、 ,它们互称为同位素
,它们互称为同位素
高频考点九 化学反应速率和化学平衡
26、(山东省实验中学2010届高三第二次诊断性测试,14)将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为
A.4.48L B.5.6L C.6.72L D.7.84L
25、(天津一中2010届高三上学期第三次月考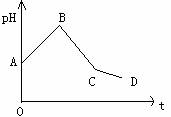 ,13)将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右图,则下列说法正确的是:
,13)将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右图,则下列说法正确的是:
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
24、(2010年苏、锡、常、镇四市高三教学情况调查一,12)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
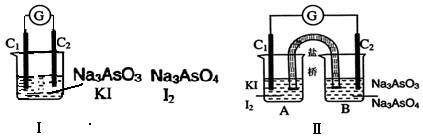
下列叙述中正确的是
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I-
23、(江苏省南京市2010届高三第二次模拟考试,6)A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B与F同主族,E与F同周期,已知常温下A、E单质的状态不同,D原子的核电荷数是B原子最外层电子数的2倍,F单质是一种重要的半导体材料。下列说法正确的是( )
A.原子半径由达到小的顺序是:
B.由A、C、D三种元素组成的化合物中可能含有离子键
C.F、C、B元素最高价氧化物对应的水化物的酸性依次增强
D.F与D形成的化合物质地坚硬,既不与酸反应也不与碱反应
高频考点八 电化学问题
22、(福建省永春一中、培元中学、季延中学、石光华侨联中2010届高三上学期期末联考,6)四种短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,Y、Z质子数
之和为21,下列说法中不正确的是 ( )
|
B.X、Y、W的氢化物中,Y的氢化物沸点最高
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的简单离子半径大于Z元素的简单离子半径
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com