
36.[化学--选修有机化学基础](15分)
某水质稳定剂是由马来酸酐和乙酸乙烯酯聚合而成,可有效防止水垢的产生。
(1)马来酸酐可由马来酸分子内脱水制得。马来酸酐分子中含有五个原子构成的环状结构;马来酸的相对分子质量为116,实验式为CHO,其核磁共振氢谱显示有两个波峰,面积比为1 : 1。
① 马来酸的分子式为 。
② 马来酸不能发生的反应是 (填写序号)。
a. 加成反应 b. 氧化反应 c. 消去反应
d. 酯化反应 e. 水解反应 f. 加聚反应
③ 马来酸酐结构简式为 。
(2)已知:Ⅰ. 在一定条件下,乙炔能分别与水、乙酸发生加成反应。
Ⅱ. 乙烯醇(CH2=CHOH)不能 稳定存在,迅速转变成乙醛。
稳定存在,迅速转变成乙醛。
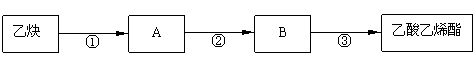 只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
写出反应②、③的化学方程式:
②
③
(3)乙酸乙烯酯有多种同分异构体。与乙酸乙烯酯具有相同官能团且能发生银镜反应的同分异构体有 种。
35. [化学-选修物质结构与性质](15分)
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3[来源:ZXXK] |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
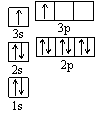
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,
其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式
,该物质的K原子和C60分子的个数比为 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,
其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式
,该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
34、(选修3-5模块)
 (1)(5分)、如图所示,
(1)(5分)、如图所示, 轻弹簧一端固定在墙上,另一端连一挡板,挡板的质量为m,一物体沿光滑水平面以一定的速度撞向挡板,物体质量为M,物体与挡板相接触的一面都装有尼龙搭扣,
使得它们相撞后立即粘连在一起,若碰撞时间极短(即极短时间内完成粘连过程),则对物体M、挡板m和弹簧组成的系统,下面说法中正确的是:
轻弹簧一端固定在墙上,另一端连一挡板,挡板的质量为m,一物体沿光滑水平面以一定的速度撞向挡板,物体质量为M,物体与挡板相接触的一面都装有尼龙搭扣,
使得它们相撞后立即粘连在一起,若碰撞时间极短(即极短时间内完成粘连过程),则对物体M、挡板m和弹簧组成的系统,下面说法中正确的是:
A.在M与m相撞的过程中,系统的动量守恒而机械能不守恒
B.在M与m相撞的过程中,系统的动量不守恒而机械能守恒
C.从M与m开始接触到弹簧被压缩到最短的过程中,系统的动量和机械能都不守恒
D.从M与m相撞后到弹簧第一次恢复原长的过程中,系统的动量不守恒而机械能守恒
(2)(10分)、大量的氢原子处于n=2的激发态,当它们跃迁回基态时,将放出大量光子,用这些光予照射金属铯时.求:
(1)从铯表面飞出的电子的最大初动能是多少电了伏?(已知氢原子基态能量为-13.6eV,铯的逸出功为1.88eV)
(2)这些电子的截止电压是多少?
33、(选修3-4模块)
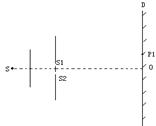 (1)(5分)、如图为杨氏双缝干涉实验示意图,其中S1、S2为双缝,D为光屏,实验中观察到屏上O点为中央亮纹的中心,P1为第一级亮纹的中心。在其它条件不变的情况下,若将D屏向右平移一段距离,则
(1)(5分)、如图为杨氏双缝干涉实验示意图,其中S1、S2为双缝,D为光屏,实验中观察到屏上O点为中央亮纹的中心,P1为第一级亮纹的中心。在其它条件不变的情况下,若将D屏向右平移一段距离,则
A.屏上O点仍然为中央亮纹的中心。
B.屏上P1位置仍然可能为亮纹的中心。
C.屏上P1位置可能为暗纹的中心。
D. 屏上干涉条纹间距将变小。
(2)(10分)、一列简谐横波沿x轴正向传播,t=0时刻波形如图所示,振幅5cm,从图示时刻起经0.5s时间x=2的质点P刚好第二次出现波峰, 求
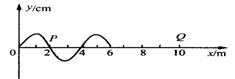 ①Q点第一次出现波峰时间
①Q点第一次出现波峰时间
②P点1.1s时位移
③P点2s钟在波的传播方向上通过的路程
32.(12分)生活中有很多问题,需要我们仔细地观察,创造性地思维,创造性地实践。
中学生需要加强创新精神的培养,课题“延长切花玫瑰保鲜期的探究”就是一例。
(1)提出问题,进行推测
插在水中的玫瑰花过几天就凋谢了,怎样让鲜花开得更久?观察凋谢的玫瑰花茎部的切口,发现有发黑和腐烂现象,这是由于 ,由此推测,玫瑰切花凋谢的原因可能是 。
(2)查阅资料,获取信息
针对提出的问题,查阅有关资料,发现海藻酸钠是比较合适的实验药品。海藻酸钠又称海藻胶,白色或淡黄色粉末,溶于水,其水溶液与钙离子反应时可形成粘胶膜。无毒,可用作食品添加剂,医学上作血浆代用品、止血剂、胶囊等。
根据以上信息,选择海藻酸钠作为延长玫瑰切花保鲜期的比较合适的实验药品的主要依据是 。
(3)设计实验,实施探究
实验一 不同浓度海藻酸钠对玫瑰切花的保鲜实验。
实验分为5个组,第1组只用自来水处理,第2-5组分别浓度为0.05moL.L-1、0.10 moL.L-1、0.20 moL.L-1、和0.40 moL.L-1的海藻酸钠溶液处理。
实验过程:剪切玫瑰花的茎部→在酒精灯火焰上灼烧切口→将切口放入海藻酸钠溶液浸泡10分钟→放入1.2%氯化钙溶液浸泡10分钟→移入清水中→观察。
实验二 玫瑰花茎部切口处膜外细菌总数检测
用无菌水洗下膜内和膜外的细菌,再用微生物培养技术分别进行计数。
(4)分析数据,得出结论
①实验一结果如下图。据图可以得出的结论是:
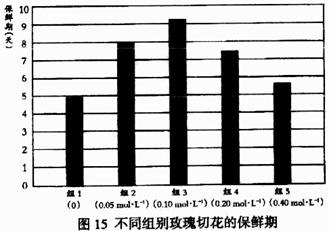
a ;
b 。
②实验二结果表明,经过海藻酸钠溶液处理的玫瑰花,茎部切口处膜外的细菌大约是膜内细菌数的10倍,这说明玫瑰花茎部切口处的粘胶膜具有  的作用。
的作用。
31.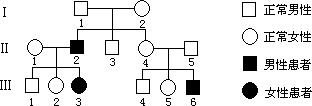 (10分)下图为人类中的一种单基因遗传病系谱图。请回答:
(10分)下图为人类中的一种单基因遗传病系谱图。请回答:
(1)仅根据该系谱图,不能确定致病基因是位于常染色体上,还是位于X染色体上。请利用遗传图解简要说明原因。(显性基因用A表示、隐性基因用a表示。只写出与解答问题有关个体的基因型即可。)
(2)如果致病基因位于X染色体上,Ⅲ5是携带者,其致病基因来自Ⅰ2的概率为__ _;如果致病基因位于常染色体上,Ⅲ5是携带者,其致病基因来自Ⅰ2的概率为_______。
(3)如果将该系谱图中一个表现正常的个体换成患者,便可以形成一个新的系谱图,而且根据新系谱图,就可以确定该致病基因位于哪种染色体上。请写出这个个体的标号和致病基因在何种染色 体上(写出一个即可)。
体上(写出一个即可)。
30.(12分)下图1是某生态系统能量流动的定量分析图解(I、II、III代表三个营养级,能量单位为百万千焦);图2是该生态系统相关内容模式图。请据图回答:
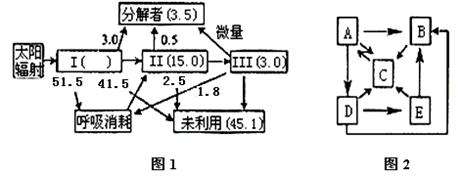
(1)图1数据正确,但是有一箭头方向错误,请指出并改正: 。
(2)图1中未标记出II的呼吸量,其呼吸量应为 百万千焦(结果保留1位小数)。
(3)图2若表示该生态系统中的食物网,则应做怎样的最小改正 ;共有 条食物链。
(4)图2若表示生态系统中的能量流动,C可表示 。
(5)图2若表示生态系统的碳循环,C可表示 。
29.(5分)请回答下列与高中生物实验有关的内容。
(1)将发芽小麦种子的研磨液置于试管中,加入现配的斐林试剂加热至沸腾,试管中
出现砖红色沉淀。说明发芽的小麦种子中含有 。
(2)在盛有10mL 3%过氧化氢溶液的试管中,加入新鲜的发芽小麦种子研磨液时,试
管中有大量气泡生成,将点燃的卫生香插入试管,火焰变得明亮,这一实验证明发芽的小麦种子中含有 。
(3)利用小麦叶片进行“叶绿体色素提取与分离”实验,层析时在滤纸条上扩散速度
最快的色素是 。
(4)为了研究小麦染色体数目、大小和形态特征,应以显微镜观察并计数小麦根尖的
分生区处于 期的细胞染色体。若以适宜浓度的秋水仙素处理培育中的小麦幼苗根部,则该根尖分生区前期细胞中的染色体数目与处理前比较其数目可能为 条。(处理前小麦染色体数目为42条)
28.(14分)“温室效应”是哥本 哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1) 其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+ 2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
 (2)在一定条件下,6H2(g) +2CO2(g)
(2)在一定条件下,6H2(g) +2CO2(g)  CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
|
CO2转化率(%) n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
 22 22 |
根据上表中数据分析:
① 温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”“不变”)。
② 该反应的正反应为 (填“吸”或“放”)热反应。
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+ CO2(g) CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是
。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是
。
a. 该条件下此反应的化学平衡常数表达式为
 b. H2的平均反应速率为0.3mol/(L·s)
b. H2的平均反应速率为0.3mol/(L·s)
c. CO2的转化率为60%
d. 若混合气体的密度不再改变时,该反应一定达到平衡状态
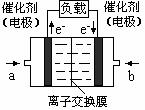
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为大于 。
27.
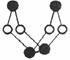 (14分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,
(14分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁, D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。
D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。
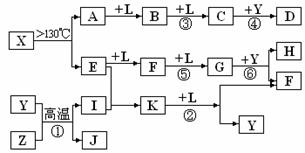
试回答下列问题:
(1)下列有关X的说法正确的是 .
A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为 ,D的分子式 ,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是 。(填序号)
(3)写出反应②的化学方程式: 。
(4)J与过量H的稀溶液反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com