
顺着一定的线索,按照一定的规律有条不紊地思考,按部就班地分析,由此及彼地推理,即为有序思维。在解题中应从题意入手,缕出条理,使分析有序,解题有据,只有这样,才能有效地防止遗漏和重复,找出正确的解题途径。
例1、现有Fe、Cu组成的合金,其总物质的量为amol,Cu的物质的量分数为x.。将合金研成粉末后全部投入含bmol HNO3的稀溶液中,微热,使其充分反应,硝酸的还原产物只有NO。
⑴用微粒符号填写下列空白(列举出全部可能的情况):
|
组序 成分 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体的成分 |
|
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中的金属离子只有Fe2+、Cu2+时,b的取值范围是(用a 、x表示) 。

转化思维是指不要被所给问题的形式所束缚,而能依具体情况进行“变通”。如将一个难题分解成几个简单的小问题将直接难求解的问题变为间接求解的问题等。这种问题变换的技巧常用于解繁杂的综合性计算题、陌生的信息题和书写复杂的化学方程式等。有些题目的思维方法分析时很繁琐,甚至会陷入绝境。如能转换一下研究对象,则会“绝处逢生”。
例1、有由环己醇、丙酮和戊醛组成的混合物共2.00g,完全燃烧后使所得气体通过盛有P2O5的干躁管,干躁管增重1.998g。原混合物的平均相对分子质量为 ( )
A. 74.75 B. 86.00 C. 71.43 D.81.33
解析:按常规方法解此题似乎不可能,但巧用转换的方法则可快速求解。由题意知,产生水的质量为 = 0.111mol。 将混合物中各物质的组成做如下“转换”:环己醇C6H12O→(CH2)6O, 丙酮C3H6O→(CH2)3O, 戊醛C5H10O→(CH2)5O,即由三者组成的混合物可看作是由CH2和O两部分组成的。设混合物中环己醇、丙酮、戊醛的物质的量分别为x、y、z,则根据CH2~H2O关系知混合物中含CH20.111mol,含O(x+y+z)mol,即有等式0.111×14 + (x
戊醛C5H10O→(CH2)5O,即由三者组成的混合物可看作是由CH2和O两部分组成的。设混合物中环己醇、丙酮、戊醛的物质的量分别为x、y、z,则根据CH2~H2O关系知混合物中含CH20.111mol,含O(x+y+z)mol,即有等式0.111×14 + (x +y+z)×16=2.00
(x+y+z)=(2.00-0.111×14)/16 =0.028 M=m总/n 总=2.00/0.028=71.43
+y+z)×16=2.00
(x+y+z)=(2.00-0.111×14)/16 =0.028 M=m总/n 总=2.00/0.028=71.43
例2、化合物(1)AB中含B 36.36%,化合物(2 )BC4中含50%,(3)则化合物ABC4中含B为( )
)BC4中含50%,(3)则化合物ABC4中含B为( )
A.12.64% B.14.09% C.19.65% D.21.1%
解析:此题乍看,似乎无从入手,甚感困惑。若据题意运用等量代换的方法来解,则十分简洁明了。将原题分为三个层次。由(1)得AB式量=B/0.3636,由(2)得B=2C,∴在ABC4中,B%=B/AB+2×2C×100%=B/A B+2B×100%=21.1%。
此解中,关键是用B作过渡桥梁。答案为ABC4。
例3、元素A、B可形成化合物X、Y,其质量组成为:X中A占23/31,Y中B占16/39。已知Y的最简式为AB,则X的最简式为( )
B+2B×100%=21.1%。
此解中,关键是用B作过渡桥梁。答案为ABC4。
例3、元素A、B可形成化合物X、Y,其质量组成为:X中A占23/31,Y中B占16/39。已知Y的最简式为AB,则X的最简式为( )
A.AB2 B.A2B C.A3B2 D.A4B3
解析:已知Y的最简式为AB,B占16/39,则A占2 3/39,若设AB式量为39(第一 次转换),则A/B=23/16,联想到23为Na,16为0(一般向具体转换,第二次转换),则最简式为N20。分子式为Na2O2。同理,设X的式量为31,A为23,B为31-23=8,得NaO1/2,即Na2O,∴X为A2B,选(B)(由具体向一般转换)。这里进行
3/39,若设AB式量为39(第一 次转换),则A/B=23/16,联想到23为Na,16为0(一般向具体转换,第二次转换),则最简式为N20。分子式为Na2O2。同理,设X的式量为31,A为23,B为31-23=8,得NaO1/2,即Na2O,∴X为A2B,选(B)(由具体向一般转换)。这里进行 了三次思维转换,灵活巧妙。
了三次思维转换,灵活巧妙。
例4 、1.5毫升0.02摩/升的石灰水3份,均加入0.02摩/升的H3PO4溶液,恰好完全反应,分别生成Ca3(PO4)2、CaHPO4、Ca(H2PO4)2,所需加入的H3PO4的体积比为( )
、1.5毫升0.02摩/升的石灰水3份,均加入0.02摩/升的H3PO4溶液,恰好完全反应,分别生成Ca3(PO4)2、CaHPO4、Ca(H2PO4)2,所需加入的H3PO4的体积比为( )
A.1:2:3 B.3:2:1 C.6:3:2 D.2:3:6
解析:若据题意列式计算,则十分麻烦。若作如下拆分变换推算,则十分简便。由上述三种生成物分子式得知,Ca、P元素的原子数之比为3:2、1:1、1:2。变换为3:2、3:3、3:6,则P元素的原子数已变换为2:3:6。而P由H3PO4提供,且浓渡已定,其量的多少显然只决定其体积了,所以H3PO4体积之比为2:3:6,答案为(D)以上三例,分别应用等量关系、联想迁延、拆分方法,论说了代换、转换、变换思维方式在解题中的作用 ,当然还有其它转换思维解题的方法,诸如:应用倍缩变换法解题,应用关系式变换法解题等。它们在求解某些计算型化学题中,都发挥了独特的重要作用。
极端思维是把研究对象或过程变化通过假设定理想的极端值,得极端情况与实际情况的对比,分析偏差发生的原因,作出合理的判断。
例1、将标准状况下的NO、NO2、O2的混合气体充满容器,倒置于水中完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度的数值范围是 ( )
A.< C <
B. < C <
C. < C <
D.无法确定
解析:此题可用极端思维来分析,因溶于水后无气体剩余,若原混合气体中无NO,则发生 4NO2 + O2 + 2H2O = 4 HNO3 的反应, 5mol气体转化为4mol HNO3,C(HNO3) = ×(mol/L) = (mol/L );若原混合气体中无NO2,则发生 4NO+3O2 + 2H2O = 4 HNO3 的反应,7mol气体转化为4mol HNO3,C(HNO3) = ×(mol/L) = (mol/L)。由于是混合气体,则所得HNO3溶液的物质的量浓度的数值范围是< C < 。
例2、在密闭容器中进行X2(g)+3Y2(g) 2Z(g)的反应,其中X2、Y2、Z的起始浓度依次为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度有可能的是(
)
2Z(g)的反应,其中X2、Y2、Z的起始浓度依次为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度有可能的是(
)
A.c(Z)=0.5 mol·L-1
B.c(Y2)=0.5 mol·L-1或c(Z)=0.1 mol·L-1
C.c(X2)=0.2 mol·L-1或c(Y2)=0.6 mol·L-1
D.c(Z)=0.4 mol·L-1
[解析]假设反应向正方向进行完全,则生成物Z的浓度为:c(Z)=0.4 mol·L-1,但该反应为可逆反应,故备选项A、D中,c(Z)≥0.4 mol·L-1不合题意。假设反应逆向进行到底,则c(X2)=0.2 mol·L-1,c(Y2)=0.6 mol·L-1,显然C也不合题意。
[答案]B
例3、用注射器吸入少量NO2和N2O4的混合气体,发生如下反应(如图所示)
2NO2(g) N2O4(g)
(1)当活塞迅速向外拉时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
(2)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
 例4、一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
例4、一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向逆反应方向移动 D.C的质量分数增加
[解析]当气体体积缩小到原来的1/2,假设平衡未发生移动(虚拟出一种中间状态),则C的浓度为原平衡时的2倍,而事实上平衡发生了移动,平衡移动的结果是C的浓度为原平衡时的1.9倍,则可认为由虚拟中间状态向逆反应方向发生了移动。即增大。
[答案]BC
例5、一容积固定真空密闭容器中,盛有1 mol PCl5,加热到200℃时发生反应:PCl5(g) PCl3(g)+Cl2(g)反应达到平衡时,PCl5所占体积分数为a%,若在同一温度和同一容器中,最初投入的是2 mol PCl5,反应平衡时,PCl5所占体积分数为b%,则a和b的关系是( )
A.a>b
B.a<b
C.a =b
D.无法比较
=b
D.无法比较
[解析](虚拟法)题目给出了状态1和状态2,为解决问题虚拟出状态3,状态3容器容积是状态1(或状态2)的2倍。
显然由状态3变到状态2只须将容器容积缩小到它的1/2即可。该过程是一个加压过程,对于题给反应,加压平衡向逆反应方向移动,PCl5物质的量及其百分含量都增大,故b%>a%。
[答案]B
整体思维,就是对一些化学问题不纠缠细枝末节,纵观全局,从整体上析题,以达到迅速找到解题切人点、简化解题的目的。
例1、将1.92g Cu 投入到一定量的浓 HNO3 中,Cu 完全溶解,生成的气体 越来越浅,共收集到标准状况下672mL气体。将盛此气体的容器倒扣在水中,求通入多少毫升标准状况下的氧气可使容器中充满液体。
越来越浅,共收集到标准状况下672mL气体。将盛此气体的容器倒扣在水中,求通入多少毫升标准状况下的氧气可使容器中充满液体。
解析:按一般解法解此题较为复杂。如果抛开细节,注意到它们间的反应都是氧化还原反应,把氧化剂和还原剂得失电子相等作为整体考虑,则可化繁为简。浓 HNO3 将 Cu氧化后自身被还原为低价氮的氧化物,而低价氮的氧化物又恰好被通入的氧气氧化,最后变成 HNO3 ,相当于在整个过程中HNO3的化合价未变,即1 .92 g Cu相当于被通入的氧气氧化。由电子得失守恒知 ×2 = ×4 解之,V(O2 )=0.336L 即通入336mLO2即可。
例2、某种由K2S和Al2S3组成的混合物中,这两种组分的物质的量之比为3:2,则含32g硫元素的这种混合物的质量是 ( )
A.64g B.94g C.70g D.140g
解析:由K2S和Al2S3的物质的量之比为3:2,可将它们看作一个整体,其化学式为K6Al4S9。得K6Al4S9~~~~9S
630 9×32
X 32g
用此方法,答案很快就出来了,为70g。
答案:C
例3、 有5.1g镁,铝合金,投入500ml 2mol/L 盐酸溶液中,金属完全溶解后,再加入4 mol/L NaOH溶液,若要达到最大量的沉淀物质,加入的NaOH溶液的体积为多少? ( )
A.300 ml B.250 ml C.200 ml D.100 ml
解析:物质之间的转化为
Mg HCl Mg2+ NaOH Mg(OH)2

 → Al3+ → Al(OH)3
→ Al3+ → Al(OH)3
Al H+ Cl- NaCl
从反应的整体来观察,原溶液里的Cl- 和加入的Na+都不参加反应,最终生成NaCl,即,n (HCl)=n( NaOH)
(HCl)=n( NaOH)
V( NaOH)= n(HCl)/ c( NaOH)=2×0.5/4=250ml
答案:B
例4、 浅绿色的Fe(NO3)2溶液中,存在如下平衡:
Fe2++2 H2O ⇌ Fe(OH)2+2H+
若在此溶液中加入盐酸后,溶液的颜色将变 ,其原因是 。
 例5 、已知脂肪烃C4H10在光照条件下和氯气发生取代反应,问其一氯取代物可能有几种?而
例5 、已知脂肪烃C4H10在光照条件下和氯气发生取代反应,问其一氯取代物可能有几种?而
解析:不少学生回答:2种。有些甚至是不假思索地口答的,还洋洋得意地说,C4H10有两种等效氢,所以一氯取代的同分异构体就是等效氢的数目。造成这样的错误,原因很大一部分在于学生没有从整体上考虑物质可能存在的结构,而是依靠记忆,或者仅凭上课模糊的印象,知道丁烷(CH3CH2CH2CH3)满足C4H10而答题的,这样答题情况,在一开始学习有机化学的时候,出现在很多学生的身上。
解题时应从C4H10整体进行考虑,由于题干中未告诉我们此分子式代表的具体是什么物质(这样的题干也是有机当中非常常见的一种情况),所以它可能是丁烷(CH3CH2CH2CH3),也可能是2-甲基丙烷((CH3)3CH),也就是说,首先要弄清C4H10本身就有两种同分异构体,接着用到“等效氢”的知识,判断出丁烷和2-甲基丙烷各有两种等效氢,所以一氯取代物应该可能有四种(Cl CH2CH2CH2CH3, CH3CH Cl CH2CH3,(CH3)3CCl,(CH3)2CH CH2Cl。)
 二、逆向思维
二、逆向思维
逆向思维是指思维程序与通常相反,不是从原因来推知结果,而是从结果入手分析解题思路,逆向思维有它的独特性,能克服思维定势的消极影响,充分运用逆向思维来求解某些化学问题时,有时比正向思维来得更简单,更巧妙。
例1、a gCu可与含有bgHNO3的溶液恰好反应。若a: b = 4:10.5,则被还原的HNO3的质量为 ( )
A. b g B. g C.g D. g
解析:Cu与HNO3反应时因硝酸的浓度的不同,其还原产物也不同。若正向思维,则参加反应的Cu与被还原的HNO3之间的量的关系难以确定。但若考虑反应中未被还原的硝酸,则问题可迎刃而解。依题意知,参加反应的Cu为 mol,起酸作用的 HNO3为mol,其质量为 mol×63g/mol = ag,进而可知被还原的HNO3的质量为(b-a)g , 因a : b = 4:10.5,即a = ,故被还原的HNO3的质量为g。
HNO3为mol,其质量为 mol×63g/mol = ag,进而可知被还原的HNO3的质量为(b-a)g , 因a : b = 4:10.5,即a = ,故被还原的HNO3的质量为g。
例2、锌粉、铁粉、镁粉的混合物4 g与一定质量25%的稀H2S O4 恰好完全反应,蒸发水分后,得固体物质100 g,则生成的氢气质量为( )
O4 恰好完全反应,蒸发水分后,得固体物质100 g,则生成的氢气质量为( )
A、2 g B、3 g C、4 g D、5 g
[解析]本题如果采用正向思维将锌、铁、镁的质量分别设未知数进行分析、计算,则过程非常复杂,头绪也较多。而采用逆向思维按以下思路解析:反应前后各元素的质量不变,由题意可知:锌、铁、镁三种金属全部参加反应,分别生成了硫酸锌、硫酸铁、硫酸镁,则蒸发水分后所得100 g固体物质(硫酸锌、硫酸铁、硫酸镁的混合物)中,包含锌、铁、镁三种元素总质量为4 g,其它的96 g则为SO4 的质量,继而根据反应中H2与SO4的关系,求得生成的氢气的质量为2 g。
由此可见逆向思维对培养思维的灵活性和敏感性是非常有益的。
例3、等质量的两种金属M和N分别与足量的稀硫酸反应,都生成+2价金属的硫酸盐和氢气。生成的氢气质量m(纵坐标)与反应时间t(横坐标)的关系如下图
(1)比较M、N两种金属的活动性强弱
(2)由图中的两条直线还可以得出的结论有
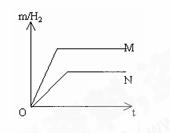
[解析]本题给出的是金属与酸反应时生成的氢气质量与时间的曲线,很多学生会感到无从下手,若是逆向思考:曲线上升得越快,说明金属与稀盐酸反应得越剧烈,该金属的活动性越强。同时从图中可以看出M产生的氢气质量比N多,完全反应所需时间少。
例4、根据以下图推断(假设能发生反应的均反应完全)
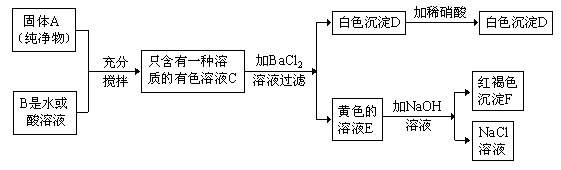
(1)若B是水,则A是 ;(填化学式)
(2)若B是酸溶液,则A是 ;(填化学式)
(3)写出C与BaCl2溶液反应的化学方程式: 。

例5、在CO和CO2的混合气体中,氧元素的质量分数为64%,将该混合气体5㎏通过足量的灼热的氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到的白色的沉淀的质量是多少?
[解析]本题如果按部就班,涉及到的反应较多 ,数据较多,计算繁琐,易于出错。而如果把握住最终反应产物是碳酸钙,采用逆向思维,找出碳酸钙和起始反应物CO和CO2的混合气体之间所存在的C-CaCO3守恒关系,则极易走出“山重水复”,迎来“柳暗花明”。
,数据较多,计算繁琐,易于出错。而如果把握住最终反应产物是碳酸钙,采用逆向思维,找出碳酸钙和起始反应物CO和CO2的混合气体之间所存在的C-CaCO3守恒关系,则极易走出“山重水复”,迎来“柳暗花明”。
12.(14分)某雷达站正在跟踪一架向雷达站飞来的飞机,在某一时刻从雷达站发出无线电波到接收到飞机反射的无线电波历时t1=2.00×10-4 s;经Δt=10 s后,从雷达站发出无线电波到接收到飞机反射的无线电波历时t2=1.86×10-4 s.求该飞机的速度大小.
解析:设飞机在某一时刻距离雷达的位移为s1,则:
s1==3.00×104 m
设飞机在10 s后距离雷达的位移为s2,则:
s2==2.79×104 m
飞机的速度v==210 m/s.
答案:210 m/s
11.(17分)在“练习使用示波器”的实验中:
(1)为了观察亮斑在竖直方向上的偏移,应该将扫描范围旋钮置于“外X”挡,使亮斑位于屏的 ,然后,应把“DC-AC”开关置于“ ”位置,以备给示波器输入一个直流电压.
(2)为给示波器输入一个Y方向的直流电压(要求从零电压开始逐渐增加),请将如图甲所示的器材与示波器连成正确的是电路.
(3)调节变阻器改变输入电压,可以看到亮斑向上的偏移随之改变,电压越高,向上的偏移越 ;调换电池正负极,改变输入电压,可以看到亮斑向 偏移.


解析:(1)扫描范围旋钮置于“外X”时,机内不提供x方向的扫描电压,故亮斑仅出现在屏的中心;然后,应把“DC-AC”开关置于直流“DC”位置,以备给示波器输入一个直流电压.
(2)因输入电压要从零开始逐渐增加,所以示波器应接在分压电路上,所以实验时仪器连接应如图乙所示.
(3)若再加大Y向电压,则亮斑会加大其在竖直方向的位移,即电压越高,向上的偏移越大;调换电池正、负极后,亮斑向下偏移.
答案:(1)中央位置,DC (2)如图所示 (3)大,下
10.(15分)示波器的“Y输入”端内阻很大,用它测量电压对被测电路的影响很小.图示为示波器测电压的示意图,假设各旋钮经调节后,示波器显示屏上纵坐标为0.50伏/格,横坐标借助标准信号源将它校准为1毫秒/格,则图中被测正弦式交变电流的电压最大值为 V,频率为 Hz.
 假设将衰减旋钮从“100”调至“1000”,则显示屏上波形纵向将 为原来的,横向将 (填“变大”、“不变”或“变小”),这时可通过调节 旋钮使波形纵向适当恢复.
假设将衰减旋钮从“100”调至“1000”,则显示屏上波形纵向将 为原来的,横向将 (填“变大”、“不变”或“变小”),这时可通过调节 旋钮使波形纵向适当恢复.
答案:1.5 250 变小 不变 Y增益
9.德国《世界报》曾报道个别西方国家正在研制电磁脉冲武器即电磁炸弹.若一枚原始脉冲功率为10千兆瓦、频率为5 kHz的电磁炸弹在不到100 m的高空爆炸,它将使方圆400 km2-500 km2范围内的电场强度达到每米数千伏,使得电网设备、通信设施和计算机的硬盘和软盘均遭到破坏.电磁炸弹有如此强大的破坏力的主要原因是( )
A.电磁脉冲引起的电磁感应现象
B.电磁脉冲产生的动能
C.电磁脉冲产生的高温
D.电磁脉冲产生的强光
解析:导体接收电磁波就是电磁感应的过程.
答案:A
非选择题部分共3小题,共46分.
8.有两部手机A和B,A的号码为12345678900,B的号码为12345678901.当用手机A(或B)拨打B(或A)的号码时,既能听到手机B(或A)的叫声,又能看到B(或A)的显示屏上显示出A(或B)的号码.现将手机A放到一个透明的玻璃罩内,并将其内部抽成真空,再用手机B拨打号码12345678900,则下列说法正确的是( )
A.既能听到A的叫声,又能看到A的显示屏上显示出12345678901
B.能听到A的叫声,但不能看到A的显示屏上显示出12345678901
C.不能听到A的叫声,但能看到A的显示屏上显示出12345678901
D.既不能听到A的叫声,也不能看到A的显示屏显示出号码
解析:A能接收呼叫信号,故显示屏显示12345678901,但由于处在真空中,故喇叭不能形成声波.
答案:C
7.在观察正弦规律变化的电压图线时,将“扫描范围”旋钮置于第一挡(10 Hz-100
Hz),把“衰减”旋钮置于“ ”挡,再调节“扫描微调”旋钮,屏上便出现完整的正弦曲线,如图甲、乙所示.则下列关于同步极性选择的说法正确的是( )
”挡,再调节“扫描微调”旋钮,屏上便出现完整的正弦曲线,如图甲、乙所示.则下列关于同步极性选择的说法正确的是( )
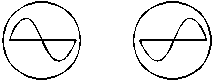
A.图甲是同步开关置于“-”的结果
B.图甲是同步开关置于“+”的结果
C.图乙是同步开关置于“-”的结果 甲 乙
D.图乙是同步开关置于“+”的结果
答案:BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com