
16.已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O化学计量数a-k均为正整数)。
回答下列问题:
⑴根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)
⑵根据反应中离子的电荷守恒,可得b、c、d、f的关系式是
⑶根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
⑷若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。
24.(10分) (1) c =2 g + 4 h (2) c - b =2 d + 3 f (3) 2 d + 3 f = g +3h
(4) 4-18 16-36
7、设生成的气体产物中NO、NO2、N2O4的物质的量分别为x、y、z
按极限思维的观点,将三组分体系转化为二组分体系。
①若气体产物中只生成NO、NO2的混合物。
则由3Cu - 2NO Cu - 2NO2
3 2 1 2
3/2x x y/2 y
 依题意: 3/2x +y/2 ==0.03mol
依题意: 3/2x +y/2 ==0.03mol
x + y ==0.05mol
解得: x ==0.005mol
y==0.045mol
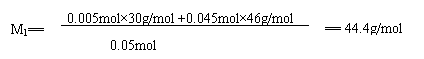
②若气体产物中只生成NO2、N2O4的混合物
则由 Cu - 2NO2 Cu- N2O4
y/2 y z z
依题意: y/2 +z ==0.03mol
y + z ===0.05mol
解得: y ==0.04mol
z==0.01mol
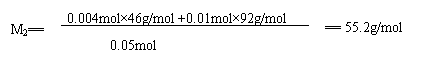
∴ M1<M<M2,
即44.4<M<55.2。
5、D 6 、A
8.24、已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO2↑+ h NO↑+ k H2O化学计量数a-k均为正整数)。
回答下列问题:
⑴根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)
⑵根据反应中离子的电荷守恒,可得b、c、d、f的关系式是
⑶根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
⑷若a=5,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。

3解析:(1)CN-是在碱性条件下被Cl2氧化的,故反应物应有OH-参加,产物除生成
氰酸盐外还应有Cl-及H2O,离子方程式为:CN-+Cl2+2OH-=CNO-+2Cl-+H2O。
(2)当Cl2过量时(1)中的产物CNO-与Cl2反应,碱性条件下不可能产生CO2及其
他气体,而碳元素的存在形式为CO32-,无毒气体一定为N2,离子方程式: 2CNO-+3Cl2+8OH-=2 CO32-+6Cl-+4H2O+N2↑
(3)由于漂白粉中的ClO-具有强氧化性,故可发生反应:CN-+ClO-=CNO-+Cl-
答案:(1)CN-+Cl2+2OH-=CNO-+2Cl-+H2O(2)2CNO-+3Cl2+8OH-=2 CO32-+6Cl-+4H2O+N2↑ (3)CN-+ClO-=CNO-+Cl-
7.0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
(A)30 (B)46 (C)50 (D)66
6、FeS与某浓度HNO3反应,生成Fe(NO3)3 、Fe2(SO4)3、NO、NO2、N2O4 和H2O,当N2O4、NO2和NO的物质的量之比为1:2:4时,实际参加反应的FeS 与HNO3的物质的量之比为
A 、2:11 B、1:5 C 、2:9 D、1:3
5、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
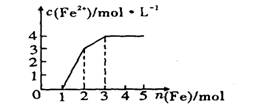
A. 1:1:1 B.1:3:l C. 3:3:8 D.1:1:4
4、三聚氰酸C3N3(OH)3,可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO ;HNCO(异氰酸,其结构是H-N=C=0)能和NO2反应生成N2、C02和H20。;
(1) 写出HNCO和N02反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
3、含有农药、染料、酚、氰化物,以及引起色度、臭味的废水,常用化学氧化法进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-)的废水.在碱性条件下(pH=8.5-11),氯气可将氰化物中CN-氧化为只有它毒性1/1000的氰酸盐(含CNO-)。
(1)写出含CN-废水用氯气氧化生成氰酸盐的离子方程式__________________ __ .
(2)若向含CNO-的废水中再通入氯气,可使CNO-转化为无毒的气体,写出这个反应的离子方程式__________________ _ _.
(3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为__________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com