
0、01 mol ),即有O.0l mol SO42一;②有BaC03为6.27 g-2.33 g=3.94 g(即O.02 mol ),
即C032- 有0.02 mol;③B a2+.Mg2+不会存在,C1-可能存 在。由于,n( NH4+)<+2
a2+.Mg2+不会存在,C1-可能存 在。由于,n( NH4+)<+2
(CO32一)+ 2(SO42一),由电荷守恒可知,必有K+。
例5.加热碳酸镁和氧化镁的混合物mg,使之完全反应,得剩余物ng,则原混合物中氧化镁的质量分数为 ( )
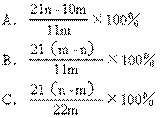
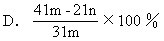
设MgCO3的质量为x
MgCO3
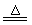 MgO+CO2↑混合物质量减少
MgO+CO2↑混合物质量减少


应选A。
例6.在Al2(SO4)3和(NH4)2SO4的混合溶液中加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为 ( )
A. B. C. D.
解析:由于NH3的物质的量为cmol,由原子守恒和电荷守恒得:(NH4)2SO4的物质的
量为mol,反应时用去的BaCl2的物质的量也为mol,剩余的BaCl2为(b-)mol,则
Al2(SO4)3中的SO42-的物质的量也为(b-)mol,由电荷守恒得:n(Al3+)×3=
(b-)×2,所以c(Al3+)=mol/L。 答案:C。
例7.常温、常压下,某气态烃与氧气的混合气体4L,充分燃烧后通过浓H2SO4,恢复到原状态气体体积变为2L,则气态烃可能是( )
1CH4;2C2H6;3C3H8;4C2H4;5C4H10。
A.仅是5 B.2和4 C.3除外 D.5除外
解析:此题是关于烃燃烧的计算。且显然又是差量计算,而2L为成分不确定的条件,仔
细审题因充分燃烧,故最后所得2L气体分两种情况:
1只为CO2,2CO2和O2。
CxHy+(x+y/4)O2→xCO2+y/2H2O △V(减少)
1 x+y/4 x 1+y/4
V(CO2) 4L-2L=2L
x∶ V(CO2)=(1+y/4)∶2
V(CO2)=(1+y/4)∶2

例8.现有Na2SO4和H2SO4的混合溶液100 mL,其中Na2SO4的浓度为0.5 mol/L ,H2 SO4
的浓度为1 mol/L。现要将上述混合溶液中Na2SO4的浓度改为0.2 mol/L,H2SO4的浓度改为2 mol/L,应加入98%(密度为1.84 g/cm3)的浓H2SO4多少毫升?然后加水 稀释到多少毫升?
解析:加98%H2SO4溶液和水稀释前后,溶质Na2SO4量不变
则设加水稀释到V mL
有关系:0.5×100=0.2×V V=250 mL
需加纯硫酸n(H2SO4)=0.25×2-0.1×1=0.4 mol
折算成98%(密度1.84 g/cm3)的硫酸体积为V=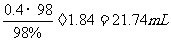
最后加水稀释至250 mL。
例9.使一定质量的锌与100mL18.5mol/L浓硫酸充分反应。
(1)若锌完全溶解,同时生成标准状况下SO2气体3. 36L,求所得溶液中硫酸锌的物质
的量浓度(假设反应前后溶液体积保持不变)。
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至
1L,测得溶液中c( H+)为0.100mol/L,求混合气体中各组分的体积比
H+)为0.100mol/L,求混合气体中各组分的体积比
解析:(1)Zn + 2H2SO4(浓)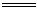 ZnSO4 + SO2↑ +
ZnSO4 + SO2↑ + H2O
H2O
1mol 22.4L
n(ZnSO4) 3.36L
则 n(ZnSO4)=0.150mol , c(ZnSO4)=1.50mol·L-1
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn+2H2SO4(浓)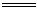 ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
2n(SO2) n(SO2)
Zn+H2SO4(稀)=ZnSO4+H2↑
n(H2) n(H2)
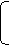 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1
n(SO2)+n(H2)=
解得: n(SO2)=0.300mol n(H2)=1.20mol
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4
[专题训练]
6.其他方法:化学计算的方法很多,除了上述5种方 法外,还有估算法、讨论法、平均值法、十字交叉法、终态法、等效平衡法等。此外近几年的上海高考中还多次出现了借助数学工具解决化学问题的计算题,测试学生将化学问题抽象成数学问题,利用数学工具,通过计算和推理,解决化学问题的能力。主要包括数轴的应用、函数的思想、讨
法外,还有估算法、讨论法、平均值法、十字交叉法、终态法、等效平衡法等。此外近几年的上海高考中还多次出现了借助数学工具解决化学问题的计算题,测试学生将化学问题抽象成数学问题,利用数学工具,通过计算和推理,解决化学问题的能力。主要包括数轴的应用、函数的思想、讨 论的方法、空间想象的能力以及不等式的迁移等方面的知识。此类题目的解题思路是:运用所掌握的数学知识,通过分析化学变量之间的相互关系,建立一定的数学关系(等式、函数、图像关系、不等式、数列等),用以解题。
论的方法、空间想象的能力以及不等式的迁移等方面的知识。此类题目的解题思路是:运用所掌握的数学知识,通过分析化学变量之间的相互关系,建立一定的数学关系(等式、函数、图像关系、不等式、数列等),用以解题。
[高考在线]
例1.将一定量的锌与100ml 18.5mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L则下列
叙述错误的是 ( )
A.气体A为SO2和H2的混合物 B.气体A为SO2和H2的体积比为4:1
C.反应中共消耗锌97.5g D.反应中共转移电子3mol

例2.有某碱金属M及其相应氧化物的混合物共10 g,跟足量水充分反应后,小心地将
溶液蒸干,得到14 g无水晶体。该碱金属M可能是 ( )
A.锂 B.钠 C.钾 D.铷
(锂.钠.钾.铷的原子量分别为:6.94.23.39.85.47)
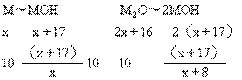 解析:设M的原子量为x
解析:设M的原子量为x
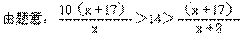
解得 42.5>x>14.5
例3.铁粉和铜粉的均匀混合物,平均分成4份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)
下列结果正确的是 ( )
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/ mL |
2240 |
4480 |
6720 |
V |
A.硝酸的浓度为4mol/L B.①中溶解了5.6gFe
C.②中溶解了9.6gCu D.④中V=8960
解析: 在①中金属剩余,则无Fe3+溶液中只有M2+,根据电子守恒(金属失去的电子=
在①中金属剩余,则无Fe3+溶液中只有M2+,根据电子守恒(金属失去的电子=
硝酸得到的电子)确定M2+应为0.15mol硝酸的物质的量=起酸作用的硝酸+被还原的硝酸
n(HNO3)=0.15mol×2+0.1mol=0.4mol
例4.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+.NH4+.Cl一.Mg2+.
Ba2+、CO32、SO42、现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集蓟气体0.04mol
(3)第三份加足量BaCl:溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。根据上述实验,以下推测不正确的是 ( )
A.K十一定存在,Cl一可能存在
B.K+可能存在,Cl一一定存在
C.100mL溶液含O.02 mol CO32一
D.NH4+一定存在,Ba2+.Mg2+一定不存在
解析:本题考查离子检验和推断及相关计算,中等题。(1)说明溶液中可能存在Cl一、
SO42一、CO32一等离子;据(2) 知NH4+有0.04 mol。据(3)知:①BaS04有2.33 g(即
5.图象法--运用图象中的函数关系分析计算一般解题思路:
(1)根据题设条件写出各步反应的化学方程式,并通过计算求出各转折点时反应物的用量和生成物的生成 量,以确定函数的取值范围。
量,以确定函数的取值范围。
(2)根据取值范围,在图象上依次作起点、转折点、终点,并连接各点形成图象。
(3)利用图象的直观性,找出其中的函数关系,快速解题。
4.极值法--极端假设的计算方法
极值法就是将复杂的问题假设为处于某一个或某两个极端状态,并站在极端的角度分析问题,求出一个极值,推出未知量的值,或求出两个极值,确定未知量的范围,从而使
复杂的问题简单化。
其主要应用于:
(1)判断混合物的组成:把混合物看成某组分的纯净物进行计算,求出最大值.最小值,再进行分析讨论。
(2)判断可逆反应中某个量的关系:把可逆反应看作向某个方向 进行到底的状况。
进行到底的状况。
(3)判断可逆反应体系中气体的平均相对分子质量的大小变化,把可逆反应看成向左或向右进行的单一反应。
(4)判断生成物的组成:把多个平行反应看作逐个单一反应。
3.关系式法--多步变化用物质的量的关系首尾列式计算
关系式法适用于多步进行的连续反应,以中间产物为媒介,找出起始原料和最终产物的关系式,可将多步计算一步完成。有时利用关系式法列出的比例式与利用原子个数守恒
列出的比例式相一致,但不能一概而论,关键在于中间过程的变化。要善于区分,正确
选择解题技巧。
|
解题的一般步骤可分为: ①准确写出有关反应的化学方程式;②深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强、密度、反应过程中热量的变化等,且该差量的大小与参加反应物质的有关量成正比;③根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。
2.守恒法--利用质量、元素(原子)、得失电子、电荷守恒计算
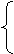 化学式:正化合价总数=|负化合价总数|
化学式:正化合价总数=|负化合价总数|
物质 电解质溶 液:所有阳离子所带正电荷总数=所有阴离子所带负电
液:所有阳离子所带正电荷总数=所有阴离子所带负电
 荷总数
荷总数



 氧化还 单一反应:氧化剂得电子总数=还
氧化还 单一反应:氧化剂得电子总数=还 原剂失电子总数
原剂失电子总数
原反应 多个连续反应:找出化合价在变化前后真正变化的物
 质及所反应的量
质及所反应的量
 化学反应 离子反应:等号两边离子所带电荷数相等
化学反应 离子反应:等号两边离子所带电荷数相等
 电化学
阳(负)极失电子总数=阴(正)极得电子总数
电化学
阳(负)极失电子总数=阴(正)极得电子总数
串联的原电池(电解池),各极上转移电子数相等
气相反应:反应物总键能=生成物总键能+反应热
化学方程式


 宏观:参加反应 m(反应物)=反应生成 m(生成物)
宏观:参加反应 m(反应物)=反应生成 m(生成物)
质量守恒定律--
微观:元素种类不变,各元素原子个数守恒
利用守恒法解题可避免书写繁琐的化学方程式和细枝末节的干扰,直接找出其中特有的守恒关系,提高解题的速度和准确度。守恒法解题成功的关键在于从诸多变化和繁杂数
据中寻找恒量对象关系。
6.有关综 合计算
合计算
 过量计算问题的分析讨论
过量计算问题的分析讨论
混合物计算和解题技巧
复杂化学式的确定方法
考查热点 无数据计算的解决方法
数据缺省型的计算方法
讨论型计算的解题思路
隐含条件题的解决方法
化学图象题的解题技巧
 认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和方法
认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和方法
解题策略 善于抓住化学与数学知识间的交叉点,运用所掌握的数学知识,通过对化学知
识的分析,建立函数关系
5.有关化学方程式的计算
 运用计算技巧进行化学方程式的有关计算
运用计算技巧进行化学方程式的有关计算
考查热点 热化学方程式中反应热、中和热、燃烧热的计算
 深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有
深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有
解题策略 关守恒关系
搞清各解题技巧的使用条件和适用范围,读懂题目,正确选择
4.有关氧化还原、电化学的计算
 氧化产物、还原产物的确定及量的计算
氧化产物、还原产物的确定及量的计算
转移电子数、电荷数的计算
考查热点 电极析出量及溶液中的变化量的计算
有关氧化还原反应的其他典型计算
解题策略 关键在于根据得失电子总数相等,列出守恒关系式求解
3.有关反应速率、化学平衡的计算
 利用化学反应速率的数学表达式进行计算
利用化学反应速率的数学表达式进行计算
考查热点 各物质反应速率间的换算
有关化学平衡的计算
 加强对速率概念、平衡移动原理的理解
加强对速率概念、平衡移动原理的理解
解题策略 将等效平衡、等效转化法等分析推理方法与数学方法有机结合,在采用常规解法的同时,可采用极值法、估算法等解题技巧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com