
1.关于运动和力的关系,以下论点正确的是( )
A.物体所受的合外力不为零时,其速度一定增加
B.物体运动的速度越大,它受到的合外力一定越大
C.一个物体受到的合外力越大,它的速度变化一定越快
D.某时刻物体的速度为零,此时刻它受到的合外力一定为零
24.(6分)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
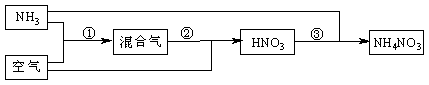
其中反应①为4NH3+5O2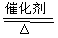 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示
为_ _。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为_________ ___。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
23.(6分)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,与0.100 mol / L HCl标准溶液反应,完全反应共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量 。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,Ba(OH)2·nH2O中的n值为 。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
22.(10分)
下图表示从固体混合物中分离X的2种方案,请回答有关问题。
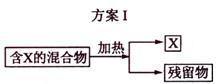
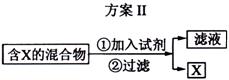
(1)选用方案I时,X应该具有的性质是 ,残留物应该具有的性质是 ;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
21.(10分)海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
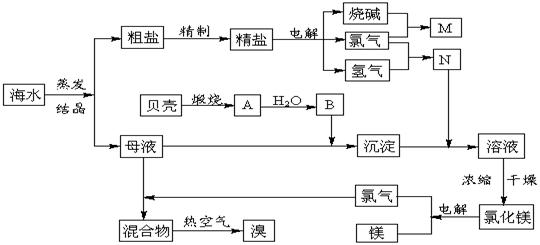
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。
则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 。
www.
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:
。
(4)此工业煅烧贝壳得到氧化钙。石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外) 。
(5)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
20.(6分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
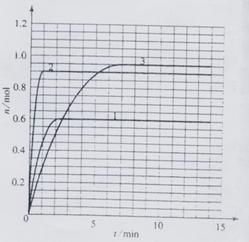 (1) 体系中发生反应的化学方程式是________________;
(1) 体系中发生反应的化学方程式是________________;
(2)列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3)该反应达到平衡时反应物X的转化率A等于___________________________;
(4)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如右图所示)则曲线1、2、3所对应的实验条件改变分别是:
1______________ 2________________ 3__________________
19.(5分)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)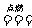 CO2(g) (
放热Q1 kJ )
CO2(g) (
放热Q1 kJ )
途径Ⅱ:先制水煤气
C(s)+H2O(g) == CO(g)+H2(g) (吸热Q2 kJ)
再燃烧水煤气
|
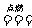 2CO2(g)
2CO2(g)
2H2(g)+O2(g) 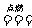 2H2O(g)
2H2O(g)
试回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是__________________。
(3)由于制取水煤气反应里,反应物所具有的总能量________生成物所具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为______ 。
18.(7分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。
现有一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____,化合价没有发生变化的反应物是__ __。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)______ _____。
(3)上述反应中, 1 mol氧化剂在反应中_____(填“得到”或“失去”)____mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
17.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
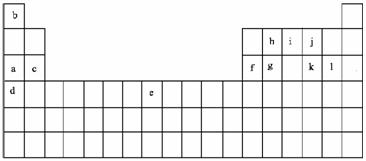
回答下列问题
⑴以上元素中原子半径最大的是 (填写元素符号)最小的是 (填写
元素名称)
⑵以上元素中,属于金属的:①在地壳中含量最高的是 ,(填写字母代号)②
单质的工业年产量最高的是 (填写周期表中的具体位置)
⑶h和g的最高价氧化物比较,熔点高的是 (填写氧化物化学式);j和
k的氢化物比较,熔点高的是 (填写氢化物化学式)
⑷以上元素两两形成的中学中常见的化合物中既有离子键,又有共价键的四核化合物有 (写一种) (填写化学式)
⑸按要求写出:①c的氧化物与l的氢化物反应的化学方程式
②都是由abjk四种元素形成的两种化合物反应的离子方程式
⑹bil三元素形成的化合物的电子式为
16.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com