
9.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

|
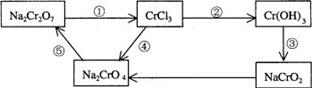
(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
8.取100mL 18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体在标况下占有的体积为22.4L。将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为( )
A.1∶2 B.2∶1 C.1∶4 D.4∶1
7.LiAlH4(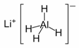 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g/mol
B.1molLiAlH4在125℃完全分解,转移3mol电子
C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O=LiAlO2+4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
6.在一定条件下,RO3n¯与氟气可发生如下反应:RO3n-+ F2 +2OH- =RO4-+ 2F-+H2O(已配平),从而可知在RO3n- 中,R元素的化合价是( )
A.+4 B.+5 C.+6 D.+7
5.今有下列三个氧化还原反应:(1)2FeCl3+2KI=2FeCl2+2KCl+I2
(2)2FeCl2+Cl2=2FeCl3 (3)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,要氧化除去I-,又不影响Fe2+和Cl-,可以加入的试剂是( )
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
4.配平以下氧化还原反应方程式: KMnO4+ H2C2O4+ H2SO4-- CO2+ K2SO4+ MnSO4+ H2O
当KMnO4消耗0.05mol时,产生的CO2的体积为________L(标准状况)。
3.下列说法中正确的是( )
A.刚落下的酸雨酸性逐渐增强,是由于雨水所含成分被不断氧化的原因
B.在同一主族中,从上到下,卤素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性在理论上应弱于铝的金属性
2.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2;②ICl+H2O=HCl+HIO下列有关叙述正确的是( )
A.反应①中,当转移0.2 mol电子时生成13.6 gZnCl2
B.反应①中,ZnI2既是氧化产物又是还原产物
C.反应①中,ZnCl2既是氧化产物又是还原产物
D.反应②中,ICl既是氧化剂又是还原剂
1.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
4、9.8gFe、Mg混合粉末溶解在一定量的某浓度的稀硝酸中,
当金属粉末完全溶解后,收集到0.2mol的NO气体(设稀硝酸的还原产物只有NO),在反应后的溶液中加入足量的KOH溶液,可生成氢氧化物沉淀的质量为(不考虑氢氧化亚铁和氧气反应)( )A.18g B.20g C.22g D.24g B
守恒最好用!!!!!!!!!!!!!!!!!!!
信心和毅力让它变成纸老虎
(09年广东化学·17)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
成功累于巩固
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com